氨是合成硝酸、铵盐和氮肥的基本原料,请问:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol•L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
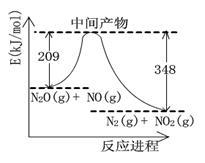
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示, 若生成1mol N2,其△H= kJ•mol-1。
(1)
用系统命名法命名烃A:______________;烃A的一氯代物具有不同沸点的产物有________种。
(2) 有机物的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
有机物的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
(3) 有机物的系统名称是__________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
有机物的系统名称是__________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
在室温下,下列五种溶液:
①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl的混合液
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是_______________________________(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是②③(填“>”“=”或“<”)。
(3)在溶液④中,离子的浓度为0.1mol/L;NH3·H2O和离子的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7, CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-)c(NH4+)(填“>”“=”或“<”)。
已知2A2(g) + B2(g) 2C(g)
2C(g) 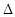 H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
(1)ab(填“>”“=”或“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达到平衡后,吸收热量c kJ,C的浓度w mol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:(用等式表示)。
(4)能说明该反应已经达到平衡的状态的是。
a.ν(C)=2ν(B2)b.容器内压强保持不变
c.ν(逆)(A2)=ν(正)(B2) d.容器内的密度保持不变
课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色。试回答下列问题: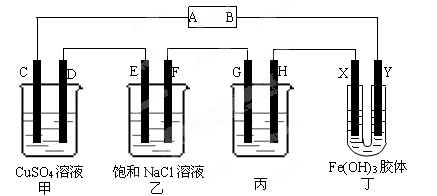
(1)电源A极的名称是。
(2)甲装置中电解反应的总化学方程式:。
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是。
(4)欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的溶质是(填化学式)。
(5)装置丁中的现象是。
依据事实,写出下列反应的热化学反应方程式。
(1)在25℃、101kPa下,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为。
(2)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为 _________________________________________________。
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为。