某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
| A.溶液A和B均可以是盐酸或NaOH溶液 |
| B.溶液A和B均可以选用稀硝酸 |
| C.若溶液B选用浓硝酸,则测得铜的质量分数偏小 |
| D.实验室方案Ⅱ更便于实施 |
一定质量的Al、Mg合金与适量的稀硫酸恰好完全反应,将反应后的溶液整个蒸干,所得固体(不含结晶水)质量比原固体增加了7.2g,则该合金的物质的量可能为
A.0.05mol |
B.0.06mol | C. 0.08mol 0.08mol |
D.0.09mol |
英国研究人员2007年8月30日发表报告认为,全球将有1.4亿人因为用水而受到砷中毒之害,导致更多的人患癌症。海带含砷超标,经水浸泡24小时后,其含砷量才能达到食用安全标准,下列对砷(As)的有关判断正确的是
| A.砷原子序数为33,它与铝为同主族 | B.砷的原子半径小于磷的原子半径 |
| C.砷化氢的稳定性比溴化氢的强 | D.砷酸的酸性比硫酸的弱 |
有一种烃的分子结构如图所示,有关该分子的说法不正确的是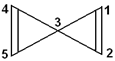
| A.该烯烃的分子式为C5H4 |
| B.该分子中1、2、4、5四个碳原子可能在同一平面上 |
| C.该烃的二氯代物同分异构体有2种 |
| D.与其互为同分异构体,且只含三键的链烃只有2种 |
恒温恒压下1 mol A和n mol B在一个容积可变的容器中发生如下反应:
A(g) 2B(g) + 2C(g),一段时间后达到平衡,生成a mol C。则下列说法中正确的是
2B(g) + 2C(g),一段时间后达到平衡,生成a mol C。则下列说法中正确的是
A.物质A、B的转化率之比一定是1∶2
B.若起始时放入3 mol A+3n mol B,则达平衡时生成3a mol C
C.起始时刻和达平衡后容器中的压强比为 (1+n)/(1+n-a/ 2)
2)
D.当v正(A) =2v逆(C)时,可断定反应达平衡
下列溶液中各微粒的浓度关系正确的是
| A.0.1 mol·L-1Na2S溶液中:2c(Na+)= c(S2-)+ c(HS-)+ c(H2S) |
| B.0.l mol·L-1pH=9的NaNO2溶液中:c(Na+)>c(NO2-)>c(OH-)>c(H+) |
| C.等pH的氨水、NaOH溶液、Ba(OH)2溶液中:c(NH4+)=c(Na+)= c(Ba2+) |
| D.向NH4HCO3溶液中滴加NaOH溶液至pH =7:c(NH4+)+ c(Na+)= c(HCO3-)+c(CO32-) |