(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
(2)已知:2NO2(g)  N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l)ΔH2
N2O4(l)ΔH2
下列能量变化示意图中,正确的是(选填字母)_____________。

A B C
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):___________________________。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。 已知某些化学键的键能数据如下表:
| 化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为 ;
.已知化合物A的分子式为C4H6O2,不溶于水,并可以发生如下图所示的变化: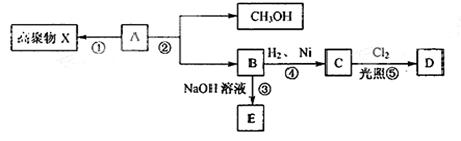
已知:C物质的一氯代物D只有两种同分异构体。请回答:
(1)A分子中含有的官能团的名称。
(2)②属于反应(反应类型)
(3)写出②的反应方程式。
(4)写出C的同分异构体中属于酯且能发生银镜反应的结构简式
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下: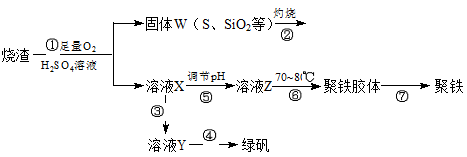
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式:。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是。
| A.品红溶液 | B.紫色石蕊试液 | C.酸性高锰酸钾溶液 | D.溴水 |
(3)过程③中,需要加入的物质是(化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是。
已知:常温常压下,D、E、F、I、J为气体; 1molE与含1molF的水溶液恰好反应生成B。B是一种常见的化肥。物质 之间有如下图所示转化关系(部分反应中生成的水已略去)。
之间有如下图所示转化关系(部分反应中生成的水已略去)。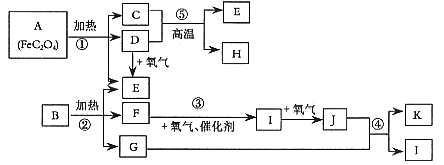
试回答下列问题:(1)已知A中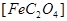 和C中Fe元素均为+2价,则
和C中Fe元素均为+2价,则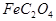 中碳元素的化合价为______
中碳元素的化合价为______
(2)B的化学式为___________________。
(3)写出反应③的化学方程式 _______________________ _____。
(4)写出过量单质H与K的稀溶液反应的离子方程式:_____________________。
2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的: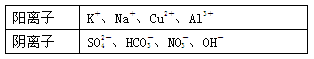
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象写出下列物质化学式:ABCDE
(9分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,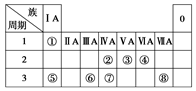
回答下列问题:
(1)画出⑧原子结构示意图__________ __
(2)④、⑤、⑥的简单离子半径由大到小的顺序是________。(用离子符号表示)
(3)①-⑧的元素中,某元素气态氢化物与其最高价氧化物对应的水化物反应所得生成物溶于水,溶液呈酸性,原因是__________________________ _(用离子方程式表示),该氢化物分子空间结构为______ _
(4)写出由元素⑥组成的单质与元素⑤最高价氧化物对应的水化物的水溶液反应的离子方程式_________________________ _