如下图所示,其中甲池的总反应式2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体 |
| D.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度 |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液:Na+,NH4+、S2—、NO3— |
| B.c(HSO4-)=0.1mol/L的溶液:K+、Ba2+、HCO3—、C1— |
| C.滴入少量苯酚显紫色的溶液:Na+、K+、I—、SO42— |
| D.能溶解碳酚钙的溶液:Na+、NH4+、C1—、Br— |
下列图示关系不正确的是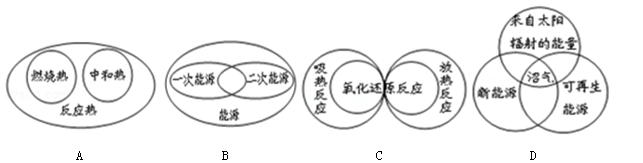
同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4, 则下列判断正确的是
| A.原子半径 X>Y>Z |
| B.非金属性 X>Y>Z |
| C.阴离子的还原性按X、Y、Z的顺序由强到弱 |
| D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
一种新型绿色电池—燃料电池,是把H2、CO、CH4气体和空气不断输入直接氧化,使化学能转变为电能,它被称为21世纪的绿色发电站,这三种气体可以作为燃料电池所需燃料的理由是
| A.都是无毒无害气体 | B.在自然界都大量存在 |
| C.都可以燃烧并放出大量的热 | D.燃烧产物均为CO2和H2O |
0.5L 1mol/L FeCl3溶液中的Cl-的物质的量浓度为
| A.3 mol/L | B.1.5 mol/L | C.1 mol/L | D.0.5 mol/L |