下列各项中,理由、结论及因果关系均正确的是
| 选项 |
理由 |
结论 |
| A |
键能:N≡N>Cl-Cl |
单质沸点:N2>Cl2 |
| B |
分子中可电离的H+个数:H2SO4>CH3COOH |
酸性:H2SO4>CH3COOH |
| C |
元素的金属性:K>Na |
碱性:KOH>NaOH |
| D |
氧化性:Fe3+>Cu2+ |
还原性:Fe2+>Cu |
已知:H2(g)+F2(g)=2HF(g) △H=-270kJ/mol,下列说法正确的是
| A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量 |
| B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270Kj |
| C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量 |
下列叙述正确的是
| A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
已知2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol;CO(g)+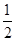 O2(g)=CO2(g);ΔH=-282.9kJ/mol,某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
O2(g)=CO2(g);ΔH=-282.9kJ/mol,某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
| A.1∶1 | B.1∶2 | C.2∶1 | D.2∶3 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g);ΔH=-192.9kJ·mol-1
O2(g)===CO2(g)+2H2(g);ΔH=-192.9kJ·mol-1
下列说法正确的是
| A.CH3OH的燃烧热为192.9kJ·mol-1 |
B.反应①中的能量变化如下图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的ΔH>-192.9kJ·mol-1 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9kJ·mol-1 |
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 ==2CO2 +3H2O,电池示意如右图,下列说法不正确的是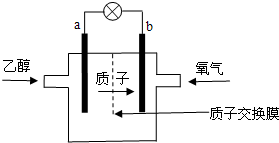
| A.a极为电池的负极 |
| B.电池工作时电流由b极沿导线经灯泡再到a极 |
| C.电池工作时,1mol乙醇被还原时就有6mol电子转移 |
| D.电池正极的电极反应为:4H+ + O2 + 4e— →2H2O |