下列实验事实所得出的相应结论正确的是
| |
实验事实 |
实验结论 |
| ① |
将木炭和浓硫酸反应生成的气体通入澄清石灰水中,有白色沉淀生成 |
该气体一定是CO2 |
| ② |
燃烧的镁条放入二氧化碳中能继续燃烧 |
还原性:Mg>C |
| ③ |
向某溶液中加入盐酸酸化的硝酸钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| ④ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液中一定有NH4+ |
A.①② B.③④ C.②④ D.①③
关于化学平衡常数的叙述正确的是…()
| A.温度一定,一个化学反应的平衡常数是一个常数 |
| B.两种物质反应,不管怎样书写化学方程式,平衡常数不变 |
| C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 |
| D.浓度商Qc<Kc,v(正)<v(逆) |
某燃料电池以熔融的K2CO3为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。下列叙述错误的是()
| A.该燃料电池的化学反应方程式为 2C4H10+13O2 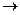 8CO2+10H2O 8CO2+10H2O |
| B.该燃料电池的负极反应式为 2C4H10+26CO 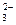 -52e-══34CO2+10H2O -52e-══34CO2+10H2O |
| C.该燃料电极的正极反应式为 26CO2+13O2+52e-══26CO 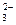 |
| D.向正极通入的气体成分主要为N2和O2 |
在密闭容器中充入4 mol X,在一定温度下4X(g) 3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是()
3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是()
| A.3.4 mol |
| B.4 mol |
| C.2.8 mol |
| D.1.2 mol |
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg[H+][OH-],则下列叙述正确的是()
| A.在25 ℃时,若溶液呈中性,则pH=7,AG=1 |
| B.在25 ℃时,若溶液呈酸性,则pH<7,AG<0 |
| C.在25 ℃时,若溶液呈酸性,则pH>7,AG>0 |
| D.在25 ℃时,溶液中pH与AG的换算公式为AG=2(7-pH) |
下图中,表示2A(g)+B(g) 2C(g)(正反应放热)。这个可逆反应的正确图象为()
2C(g)(正反应放热)。这个可逆反应的正确图象为()