已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氢气中1 molH―H 键完全断裂时吸收热量436 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ, 则氧气中1 molO="O" 键断裂时吸收热量为
| A.188kJ | B.248 kJ | C.124kJ | D.496kJ |
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1 C(s)+1/2O2(g)===CO(g);△H2
②S(s)+ O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);
O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g); △H4
△H4
③H2(g)+1/2O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8[
| A.① | B.④ | C.②③④ | D.①②③ |
下列事实不能用电化学原理解释的是
| A.铝片不需要特殊的保护方法 | B.炒过菜的铁锅未清洗易生锈 |
| C.轮船水线以下的船壳上镶有一定数量的锌 | D.镀锌铁比镀锡铁耐腐蚀 |
下列关于热化学反应的描述中正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则稀H2SO4和Ba(OH)2反应的中和热为ΔH=2×(-57.3) kJ/mol |
| C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) 反应的ΔH=+2×283.0kJ/mol |
下列关于化学反应的自发性叙述中正确的是
| A.焓变小于零而熵变大于零的反应肯定是自发的 |
| B.焓变和熵变都小于零的反应肯定是自发的 |
| C.焓变和熵变都大于零的反应肯定是自发的 |
| D.熵变小于零而焓变大于零的反应肯定是自发的 |
有甲、乙两个装置,下列说法错误的是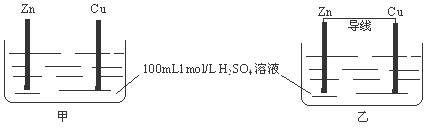
| A.甲、乙装置中,Zn的质量均减小 |
| B.甲、乙装置中,Cu上均有气泡产生 |
| C.化学反应速率乙 > 甲 |
| D.甲中H+移向Zn,乙中SO42-移向Zn |