煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:

①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.3kJ·mol﹣1
②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.3kJ·mol﹣1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g) N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①10~20min内,N2的平均反应速率v(N2)= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母序号).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol·L﹣1,在该条件下达到平衡时,CO的转化率为 .
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.

①乙中A极产生的气体在标准状况下的体积为 .
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是 (填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0mol·L﹣1 NaOH溶液.
现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下: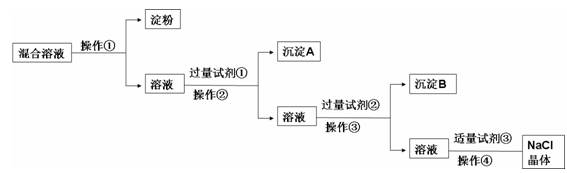
(1)a.操作①是利用胶体中胶体粒子______________(填“能”或“不能”)透过半透膜,溶液溶质分子、离子__________(填“能”或“不能”)透过半透膜进行分离提纯。
b.如何用实验证明淀粉未透过半透膜而Cl-已透过半透膜:
______________________________________________________
___________________
(2)写出上述实验过程中所用试剂:
试剂①_______________________;试剂③________________________。
(3)判断试剂①已过量的方法是:________________________________________。
(4)用化学方程式表示加入试剂②的作用:
____________________________________________________________________
(5)操作④的名称是__________________________。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。 (1)合成氨反应N2(g)+3H2(g)2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);使用
(1)合成氨反应N2(g)+3H2(g)2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);使用 催化剂后反应的△H(填“增大”“减小”或“不改变”)。
催化剂后反应的△H(填“增大”“减小”或“不改变”)。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应: 2 N2O5(g)4NO2(g)+O2(g)△H>0
2 N2O5(g)4NO2(g)+O2(g)△H>0
①下表为反应T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| C(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内 N2O5的分解速率为。
N2O5的分解速率为。
②在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2T1(填
“>”“<”“=”)
(3)已知肼分子(H2N—NH2)可以在 氧气中燃烧生成氮气和水。
氧气中燃烧生成氮气和水。
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
②用电离方程式表示肼的水溶液呈碱性的原因
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(1)+2H2O2(1)==N2(g)+4H2O(g)△H= —642.2kJ·mol-1
因此肼可以作为火箭推进剂。根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼。说明原因。
有机物F(C13H16O2)是一种芳香酯,可用作香精的调香剂。如图是该有机物的合成路线: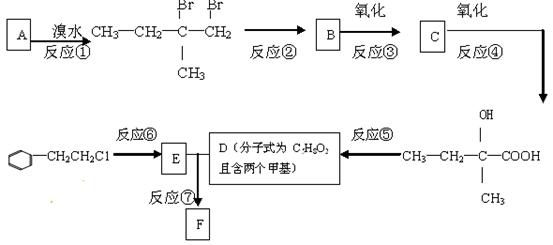
请回答下列问题:
(1)反应②中另加的试剂是;反应⑤的一般条件是:。
(2)反应③的化学方程式为 。
。
(3)反应⑦的化学方程为。
(4)上述合成路线中属于取代反应的是(填编号)。
(5)C的同分异构体有多种,其中能发生水解反应的有机物有种。
(11分)都由短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气味气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色 溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与一种相对分子质量为78的供氧剂的结构和化学性质相似,其溶液显黄色.
溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与一种相对分子质量为78的供氧剂的结构和化学性质相似,其溶液显黄色.
请回答下列问题:
(1)组成单质A的元素位于周期表中的位置。
(2)指出H物质中的化学键类型。
(3)写出B与氢氧化钠溶液反应的离子方程式:______________________。
(4)E被足量 NaOH溶液吸收得到溶液中的离子浓度由大到小关系是。
NaOH溶液吸收得到溶液中的离子浓度由大到小关系是。
(5)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.当生成2 mol二氧化氯时,转移电子________mol.
(6)溶液F在 空气中长期放置生成H的化学反应方程式为:。
空气中长期放置生成H的化学反应方程式为:。
硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物 石膏(CaSO4·2H2O)的生产流程示意图:
石膏(CaSO4·2H2O)的生产流程示意图: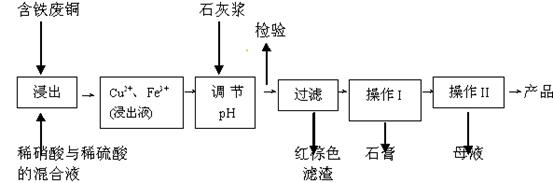
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
温度(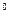 C) C) |
20 |
40 |
60 |
80 |
100 |
| 石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
| 胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是;
(2)写出浸出过程中生成硫酸铜的离子方程式;
(3)操作I包括蒸发浓缩、等操作,温度应该控制在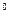 C左右;
C左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为、、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是;干燥时采用晾干,不用加热烘干的原因是。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是;
②指出你认为不合理方案存在的问题是。