【2015年新疆自治区、兵团】实验室常用碳酸钙和稀盐酸反应制取二氧化碳。化学兴趣小组的同学们想探究反应后废液中溶质的成分,请你一同参与探究并回答问题。
【提出问题】废液中的溶质是什么物质?
【作出猜想】玉素甫同学认为:废液中溶质只有氯化钙;
阿依古丽同学认为:废液中含有的溶质是氯化钙和氯化氢
【查阅资料】氯化钙溶液呈中性。
【实验与结论】
(1)请写出实验室制取二氧化碳反应的化学方程式 。
【玉素甫同学做对比实验】
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量废液于试管中,滴入无色酚酞溶液。 |
溶液无色 |
废液中溶质只有氯化钙 猜想正确 |
| 取少量氯化钙溶液于试管中,滴入无色酚酞溶液。 |
溶液无色 |
【实验评价】
(2)你认为玉素甫同学的实验 (填“能”或“不能”)证明他的猜想,理由是 。
(3)如果你要证明阿依古丽同学的猜想是正确的,你选择 (填字母:A.紫色石蕊试液 B.氢氧化钠溶液 C.稀盐酸)来代替酚酞试液,理由是 。
(4)若实验证明了阿依古丽同学的猜想是正确的,向废液中加入过量的 ,反应完成后过滤就可得到只含氯化钙一种溶质的溶液。
材料1:人类要在月球生活居住,首先离不开淡水和氧气,而月球上既没有水又没有空气。科学家发现月球的沙土中含有丰富的含氧钛铁矿,成分为TiO2、Fe2O3的混合物,将这些矿石利用CO来还原提炼单质钛和铁,若用氢气还原,可以得到淡水。将这些矿石通电,还可以从中分离出氧气。
材料2:钛与多数金属一样不能被磁性材料吸引。
(1)月球土壤中存在天然的铁、金(Au)、银等多种金属矿物颗粒。若从铁、金、银混合金属中回收某些金属,将混合金属放入足量的盐酸中充分反应,然后过滤,剩余的固体中的金属是 。
(2)下列实验证明了铁在潮湿的空气里会发生锈蚀,证明氧气一定参加了反应必须要做的实验是 (填序号)。
从铁生锈条件来分析,月球上铁制品(填“易”或“不易”)生锈,原因是: 。
(3)现利用CO来还原TiO2、Fe2O3的混合物提炼单质钛(Ti)和铁,装置如图所示。
试回答:
①写出CO还原钛铁矿生成钛的发生反应化学方程式 。
②可用简单的物理方法将钛和铁两种物质分开,该方法是 。
③就实验操作顺序的问题两位同学出现了分歧。瑞莲同学认为先通一段时间CO排出空气,然后再点燃C和A中的酒精灯,钱旭同学认为这样做不好,其理由是 ;钱旭认为先点燃C和A中的酒精灯,然后再通CO,瑞莲也提出反对,她的理由是 。
老师认为她们的反对意见都有一定道理,于是给这两位同学提供了氮气,帮助她们解决了的困难。你认为她们应是怎么安排通气和点酒精灯的顺序的? 。
实验装置的设计和组装往往可以优化,请观察下列装置并回答相关问题。
(1)A装置中发生反应的化学方程式是 。
(2)根据A 装置的适用条件改进后得到B装置,其中仪器c 的名称是 。实验室若用B装置制氧气,反应的化学方程式是 。
(3)选择气体收集方法时,气体的下列性质:①颜色 ②密度 ③溶解性 ④可燃性,必须考虑的是 (填序号)。
(4)D装置可用于收集密度比空气 (填“大”或“小”),且不与空气反应的气体。E装置从a、b 中某一个接口进气,可以代替C、D 装置收集气体,并且可以减少气体向空气中的逸出。现用A、E装置来制取二氧化碳,连接A装置的应是口(填“a”或“b”)。
用下图的装置来测定空气中氧气的体积分数。
(1)盛放在燃烧匙内的物质可用_______。过量的目的是
(2)实验中观察到的现象是__________,同时水进入广口瓶,水的体积约占广口瓶容积的_____________。
(3)如果发现水流入集气瓶的体积不足五分之一,这可能是由哪几种原因引起的?(至少写出两种)
(4)图Ⅰ实验除了可以得出氧气约占空气体积1/5的结论外,还可以得出有关氮气性质的哪些结论
图中A是高粱、玉米和薯类等经过发酵、蒸馏得到的一种可再生能源,现已在汽油中加入一定量的A,可节省石油资源,减少汽车尾气的污染,G是常见白色难溶盐。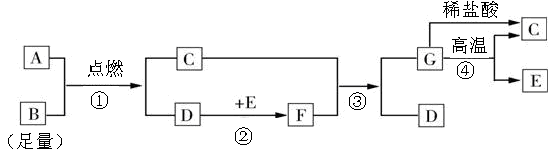 (1)物质A俗称;物质E的化学式是
(1)物质A俗称;物质E的化学式是
(2)反应①的化学方程式是:;
(3)反应②的基本反应类型是;反应④的基本反应类型是;
(4)反应③的化学方程式是:.
小明和小艳在实验室配制石灰水时,小明同学将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是他认为熟石灰样品已经变质。小艳同学不同意他的判断,你认为小艳同学的理由是。同学们针对该熟石灰样品的成分展开了讨论,请你参与讨论并完成实验报告。
【提出问题】 熟石灰样品的主要充分是什么?
【作出猜想】 甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3
你认为是。
【实验与结论】 请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤。 向滤液中加入适量的溶液; 向滤出固体中加入适量溶液。 |
; 。 |
猜想正确 |
【拓展与应用】小组同学反思了熟石灰变质的原因,认识到实验室应保存熟石灰。