【2015年广西省桂林市】菱铁矿(主要成分是FeCO3)是炼铁的原料。现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如下图所示。

已知:①FeCO3+H2SO4=FeSO4+CO2↑+H2O
②菱铁矿中杂质不参加反应,且难溶于水。
请计算:
(1)20.0g菱铁矿中FeCO3的质量为 g。
(2)列式计算所用稀硫酸的溶质质量分数(结果准确到0。1%)
实验室现有固体高锰酸钾31.6g,如忽略加热高锰酸钾时的各种损失,并使其完全受热分解,则最多可制取多少克氧气?
以下是小华与小军对以上问题的两种解题过程,请你仔细观察该解题过程,并回答其后的问题。
(1)小华同学的解法是错误的,理由是。
(2)小军同学的解法除了格式错误外,其最主要错误是。
(3)请你写出该题正确的完整的解题过程。
工业上常用NaOH溶液处理铝土矿(主要成分Al2O3),反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O。欲对含Al2O3 204 t 的铝土矿进行处理(杂质不参与反应),理论上需要消耗NaOH的质量为多少?
实验中学化学兴趣小组为了测定某含铁样品中铁的质量分数,取10克样品放入烧杯中,再取稀盐酸分五次加入烧杯中,每次均充分反应(杂质不溶于水,也不参加反应),测得实验数据如下:求:(1)此含铁样品中铁的质量分数。(2)恰好完全反应时所得溶液中溶质的质量分数。
(8分)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放人烧杯中,向其中加入50g稀盐酸,二者恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算石灰石中杂质的质量分数。
加热氯酸钾和二氧化锰固体混合物制取氧气时,反应时间和剩余固体质量如图.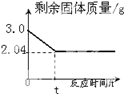
(1)根据质量守恒定律,该反应产生的氧气质量为g.
(2)求原固体混合物中氯酸钾的质量是多少?