某溶液中含有大量的Cl-、CO32-、OH-等三种离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是
(1)滴加Mg(NO3)2溶液;(2)过滤;(3)滴加AgNO3溶液;(4)滴加Ba(NO3)2溶液
| A.(1)(2)(4)(2)(3) | B.(4)(2)(1)(2)(3) |
| C.(1)(2)(3)(2)(4) | D.(4)(2)(3)(2)(1) |
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物。下列有关判断正确的是 ( )。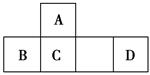
A.简单氢化物的热稳定性:C>A
B.最高价氧化物对应水化物的酸性:D<C
C.B的最高价氧化物的水化物能与C的最高价氧化物的水化物反应
D.A、C、D的含氧酸的钠盐水溶液可能均显碱性
短周期元素甲、乙、丙、丁的原子序数依次增大。甲的最高价氧化物与乙的气态氢化物同时通入水中,得到的生成物既可与酸反应又可与碱反应。丙位于第ⅠA族,丁原子的核外电子总数是其最外层电子数的3倍,则 ( )。
| A.气态氢化物的稳定性:乙<丁 |
| B.原子半径:甲<乙 |
| C.丙的两种氧化物都是离子化合物 |
| D.甲、乙、丁的最高价氧化物对应的水化物酸性依次增强 |
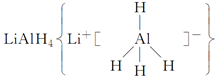 、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。
、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。
| A.LiH与D2O反应,所得氢气的摩尔质量为4 g·mol-1 |
| B.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 |
| C.LiAlH4溶于适量水得无色溶液,则化学方程式可表示为LiAlH4+2H2O=LiAlO2+4H2↑ |
| D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
已知离子方程式:As2S3+H2O+NO3—―→AsO43—+SO42—+NO↑+______K(未配平),下列说法错误的是( )。
| A.配平后水的化学计量数为4 |
| B.反应后溶液呈酸性 |
| C.配平后氧化剂与还原剂的物质的量之比为3∶28 |
| D.氧化产物为AsO43—和SO42— |
氯酸是一种强酸,浓度超过40%时会发生分解,该反应可表示为aHClO3―→bO2↑+cCl2↑+dHClO4+eH2O,下列有关说法不正确的是 ( )。
| A.由反应可确定氧化性:HClO3>O2 |
| B.由非金属性:Cl>S,可推知酸性:HClO3>H2SO4 |
| C.若氯酸分解所得1 mol混合气体的质量为45 g,则反应的化学方程式可表示为3HClO3===2O2↑+Cl2↑+HClO4+H2O |
| D.若化学计量数a=8,b=3,则生成3 mol O2时该反应转移20 mol电子 |