下列说法或表示法正确的是
| A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 |
| B.需要加热的反应说明它是吸热反应 |
C.在稀溶液中:H+(aq)+OH-(aq) H2O(l) ΔH =-57.3 kJ·mol -1,若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ H2O(l) ΔH =-57.3 kJ·mol -1,若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ |
D.1mol S完全燃烧放热297.3 kJ,热化学方程式为:S+O2 SO2 ΔH=-297.3 kJ·mol-1 SO2 ΔH=-297.3 kJ·mol-1 |
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )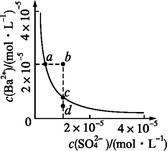
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )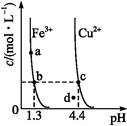
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
| A.n(Ca2+)增大 | B.c(Ca2+)不变 | C.c(OH-)增大 | D.n(OH-)不变 |
溶度积常数表达式符合Ksp=·c(By-)的是( )
A.AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
B.Na2S 2Na++S2- 2Na++S2- |
C.Ag2S(s) 2Ag+(aq)+S2-(aq) 2Ag+(aq)+S2-(aq) |
D.PbI2(s) Pb2+(aq)+2I-(aq) Pb2+(aq)+2I-(aq) |