可逆反应A(g)+3B(g) 2C(g);ΔH=-Q kJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是
2C(g);ΔH=-Q kJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是
A.甲中A的转化率为75%
B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25 molA、0.75molB 、1.5molC,平衡向正反应方向移动
D.乙中的热化学反应方程式为2C(g) aA(g)+3B(g);ΔH=+Q2kJ·mol-1
aA(g)+3B(g);ΔH=+Q2kJ·mol-1
下列表示物质结构的化学用语或模型图正确的是
A.H2O2的电子式: |
B.CS2的比例模型: |
C.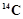 的原子结构示意图: 的原子结构示意图: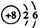 |
D.CCl4的结构式: |
下列各组中化合物的性质比较,不正确的是
| A.酸性:HClO4>HBrO4>HIO4 |
| B.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C.非金属性:F>O>S |
| D.稳定性:PH3>H2S>HCl |
一个原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是
| 正极 |
负极 |
电解质溶液 |
|
| A |
Zn |
Cu |
CuCl2 |
| B |
Zn |
Cu |
ZnCl2 |
| C |
Cu |
Zn |
CuSO4 |
| D |
Cu |
Zn |
ZnSO4 |
苯与甲苯相比较,下列说法不正确的是
| A.都能在空气燃烧产生浓烟 |
| B.苯不能使酸性的高锰酸钾溶液褪色,甲苯能使酸性的高锰酸钾溶液褪色 |
| C.都不能因反应而使溴水褪色 |
| D.苯比甲苯更容易与硝酸反应 |
在离子RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
A.A-x+n+48 B. A-x+n+24 C. A-x-n-24 D A+x-n-24