相同温度下,两个恒压密闭容器中发生可逆反应X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6kJ·mol-1实验测得反应在起始及达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6kJ·mol-1实验测得反应在起始及达到平衡时的有关数据如下表所示:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
0.1 |
0.3 |
0 |
4.63kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0)kJ |
下列叙述正确的是
A.反应的平衡常数:①>②
B.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C.达到平衡时,容器①、②中各物质的百分含量相同
D.若容器①体积为0.20L,则达平衡时放出的热量大于4.63kJ
可逆反应2NO2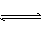 2NO+O2在恒温恒容的密闭容器中,达到平衡状态的标志是()
2NO+O2在恒温恒容的密闭容器中,达到平衡状态的标志是()
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生
②单位时间内生成n mol O2的同时生 成2n mol NO
成2n mol NO
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③ ④⑤ ④⑤ |
B.②③⑤⑦ | C.①④⑥⑦ | D.全部 |
下列各项中前后两个叙述都正确的是()
| A.单质分子中一定存在共价键;最外层有2个电子的原子都是金属原子 |
| B.非极性键可以存在于离子化合物中;质子数相同的粒子不一定属于同种元素 |
| C.同位素的化学性质几乎完全相同;任何原子的原子核都是由质子和中子构成的 |
| D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构; 伴有能量变化的物质变化都是化学变化 |
下列物质中含有非极性键的共价化合物是()
| A.H2O2 | B.CH4 | C.Na2O2 | D.I2 |
根据元素周期表和元素周期律,下列推断中错误的是()
A.砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸 |
B.在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素 |
C.镭(第ⅡA族)的硫酸盐难溶解于水,其氢氧化物是强碱 |
D.溴化氢没有氯化氢稳定,其水溶液的还原性是盐酸弱于氢溴酸 |
下列排列顺序正确的 是()
是()
①热稳定性:H2O>HF>H2S②离子半径: F->Na+>Mg2+>Al3+ ③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-
③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-
| A.①③ | B.①④ |
C.②④ | D.②③ |