某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
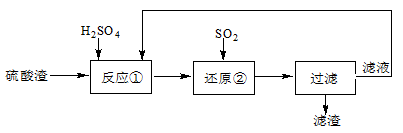
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右所示。得出结论:该反应的温度不宜过高。
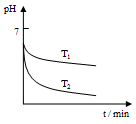
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:
2Fe3++2I-=2Fe2++I2;2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,经 10min后反应达平衡时有3molSO2发生了反应。试计算:
10min后反应达平衡时有3molSO2发生了反应。试计算:
1)用SO2表示该反应的反应速率为多少?
2)O2的转化率为多少?
3)平衡常数K为多少?
把2.0 mol/L CuSO4溶液和1.0 mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:
(1)混合溶液中CuSO4的物质的量浓度;
(2)向溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时溶液中的Fe2+的物质的量浓度。
将BaCl2·xH2O的晶体2.44g溶于水,配成100mL溶液,取此溶液25mL,与8.5g 10%的AgNO3溶液相作用,刚好把Cl-沉淀完全。求:
(1)求2.44g BaCl2·xH2O的物质的量;
(2)求BaCl2·xH2O的相对分子质量;
(3)求BaCl2·xH2O的x值。
将0.8g氢气与14.2g氯气反应完全后,刚好被含有适量氢氧化钠的溶液吸收,最终溶液质量为58.5 g。
g。
⑴求生 成HCl气体的质量为多少克?
成HCl气体的质量为多少克?
⑵最终溶液中氯化钠的质量分数。
“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240 g/mol-1;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%氧元素的质量分数为28%,其余为N、S。(写计算过程)
(1)误食0.1 g“毒鼠强”就可以使人死亡,0.1g“毒鼠强”的物质的量为多少?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比。