下列有关实验原理或实验操作正确的是
| A.用广泛pH试纸测得饱和氯水的pH约为2.2 |
| B.用量筒量取7.60 mL 0.1 mol·L-1盐酸 |
| C.用图1所示的操作可检查装置的气密性 |
| D.实验室用图2所示的装置制取少量的NO |
下列各化合物中,能发生酯化、还原、加成、消去四种反应的是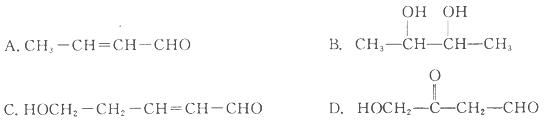
某一有机物A可发生下列变化:
已知c为羧酸,且.C、E均不能发生银镜反应,则A的可能结构有
A.1种 B.4种 C.3种 D.2种
某有机物A是农药生产中的一种中间体,其结构简式如图所示。下列叙述中正确的是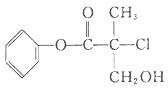
| A.有机物A属于芳香烃 |
| B.有机物A可以与Br2的CCl4溶液发生加成反应 |
| C.有机物A与浓硫酸混合加热,可以发生消去反应 |
| D.1 molA与足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1 mol C3H6Cl2中化学键总数为 |
B.42 g乙烯中含碳原子数为3  |
C.标准状况下,1L苯完全燃烧生成的气态产物的分子数为(6/22. 4) |
D.0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3  |
下列各组有机物中,无论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗的氧气及生成的水的物质的量也不变的是