用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。
2Cl2(g)+2H2O(g)。
(1)研究表明反应A通过如下图所示的催化剂循环实现。
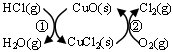
反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(g) ΔH1
H2O(g)+CuCl2(g) ΔH1
反应②生成1molCl2(g)的反应热为ΔH2,则A反应的反应热表示为 。(用ΔH1和ΔH2表示)。
(2)反应A中,4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如下:
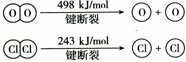
①H2O的电子式是 ,反应A的热化学方程式是 。
②断开1 mol H—O键与断开 1 mol H—Cl 键所需能量相差约为 kJ,H2O中H—O 键比HCl中H—Cl键 (填“强”或“弱”)。
(3)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
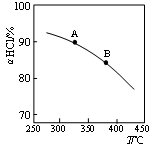
实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如上图所示,若压缩体积使压强增大,画出相应ɑHCl—T曲线的示意图,并简要说明理由 。
等质量的甲、乙、丙、丁、戊、己6种只含C、H、O三种元素的有机物,分别充分燃烧时,消耗等量的O2,且生成的气体全部分别通过足量的无水硫酸铜后再分别通过足量的碱石灰,无水硫酸铜与碱石灰质量增重之比均为9∶22。已知:
① 6 M(甲)=3 M(乙)=3 M(丙)=3 M(丁)=2 M(戊)=M(己)=180;
② 乙、戊的水溶液可使甲基橙试液变红,相互之间在一定条件下能发生酯化反应;
③ 戊的核磁共振氢谱有4种峰,峰面积之比为3∶1∶1∶1;
④ 甲、丙、丁、己能发生银镜反应。丙不易溶于水但丁易溶于水。
请回答下列问题:
(1)甲的结构式为;己的一种可能的结构简式为。
(2)乙、丙、丁三者之间的关系是;丁的结构简式为。
(3)写出2分子戊生成1分子环状酯的化学方程式。
哈佛大学教授Elias James Corey因提出“逆合成分析原理”,将有机合成路线设计技巧艺术的变成了严格的思维逻辑科学而获得1990年诺贝尔化学奖。逆合成分析法可示意如下:
下图是某同学运用逆合成分析法分析合成二乙酸-1,4-环己二醇酯的中间体和基础原料的示意图,请回答有关问题: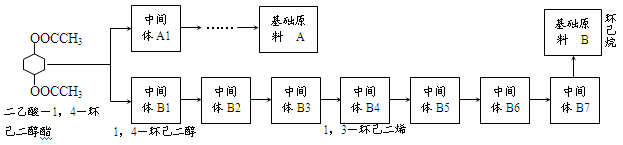
(1)基础原料A的电子式为。由A到A1,最少经过步反应。
(2)写出下列物质转化时的反应条件和反应类型:
①B→B7。反应条件:,反应类型;
②B7→B6。反应条件:,反应类型。
(3)写出下列反应的化学方程式,注明反应条件:
①B5→B4:;
②B3→B2:。
实验室配制少量银氨溶液的方法是先向洁净的试管中加入溶液,然后逐滴加入生成白色沉淀,反应的离子方程式是①______________________________ ;继续滴加至沉淀恰好溶解,即得银氨溶液,反应的离子方程式为②_________________________________;
( 共3分)把2g甲醛气体溶于6g冰醋酸中,再加入4g葡萄糖得混合物甲;另取5g甲酸甲酯和8g乳酸[CH3CH(OH)COOH]混合,得混合物乙;然后将甲和乙两种溶液按7∶4的质量比混合得丙。则甲中碳元素的质量分数为,乙中氢元素的质量分数为,取60g丙完全燃烧,消耗O2的物质的量为 mol。
(7分)在下列物质中选择相应的序号填空:
①甲烷 ②乙烯 ③乙炔 ④甲苯 ⑤1-丁醇 ⑥乙酸乙酯 ⑦甘氨酸
Ⅰ.分子结构为正四面体的是;
Ⅱ.分子中中心原子采取sp杂化的是;
Ⅲ.能发生水解反应的是;
Ⅳ.能与溴水反应并使其褪色的是;
Ⅴ.分子与分子之间存在氢键的是;
Ⅵ.能发生消去反应的是
Ⅶ.与酸或碱都能反应生成盐的是。