发生在天津港“8·12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注。
(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:①H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
②C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为: 。
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受 到了严重的氰化物污染。处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
(4)电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+====5O2↑+2N2↑+2H2O,则阴极反应式为 。

(5)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。
已知在常温下:Ksp[Fe(OH)2]= 1×10-15、Ksp[Fe(OH)3]= 1×10-38、
Ksp[Cr(OH)3]= 1×10-23,当离子浓度在1×10-5mol/L以下时认为该离子已经完全沉淀,请回答:
① 相同温度下Fe(OH)3的溶解度 Cr(OH)3的溶解度(填“>”、“<”或“=”)
② 浓度为0.1mol/L的Fe2+与10. 0mol/L Cr3+同时生成沉淀的pH范围是 。
合成氨是人类科学技术发展史上的一项重大突破。合成氨反应的化学方程式为N2(g)+3H2(g)≒2NH3(g)。一定条件下,在密闭容器中反应达平衡后,请回答:
(1)若增大N2的浓度,则化学反应速率(填“增大”或“减小”),化学平衡
(填“向正反应方向”、 “向逆反应方向”或“不”)移动,N2的转化率_________。
“向逆反应方向”或“不”)移动,N2的转化率_________。
(2)若加入适当的催化剂,则化学反应速率增大,化学平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)若减压时,N2的质量分数_________。(填“增大”“减小”或“不变”,)
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是 (选填序号字母)。
(选填序号字母)。
a、及时分离出NH3 b、升高温度 c、增大压强 d、使用催化剂
(5)写出该反应的化学平衡常数表达式:K= 。
已知下列热化学方程式:
① H2(g) + 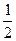 O2(g) = H2O(l)△H = -285.8 kJ / mol
O2(g) = H2O(l)△H = -285.8 kJ / mol
② C(s) + O2(g) = CO2(g)△H = -393.5 kJ / mol
③ C(s) + H2O(g) =" CO(g)" + H2(g)△H = +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是(填序号,下同),属于吸热反应的是。
(2)1 mol H2完全燃烧生成液态水,放出的热量为。
(3)碳的燃烧热△H= 。
(4) 在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式。
(4分)(1)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(2)在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH≒CH3COO-+H+ΔH > 0
下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(10分).已知有以下物质相互转化
试回答:(1)写出B的化学式,D的化学式,
(2)写出由E转变成F的化学方程式。
(3)用KSCN鉴别G溶液的阳离子实验现象是。
向G溶液加入A的有关离子反应方程式
(8分)证明某白色晶体是(NH4)2SO4的简单实验操作如下:取少量白色晶体于一小烧杯中,加入适量蒸馏水制成溶液。
(1)证明溶液中含SO42-,主要的实验操作及现象为:
发生反应的离子方程式是:
(2)证明溶液中含有NH4+,主要实验操作及现象为
发生反应的离子方程式是: ____________