(金科选作)(15分)某溶液X中含有H+、Ba2+、Al3+、NH4+、Fe3+、Fe2+、CO32-、SO32-、Cl-、SO42-、NO3-中的几种(除此以外,无其他大量存在的离子),针对该溶液进行实验,内容
如下:
①用洁净的玻璃棒蘸取少量X溶液,点在pH试纸上,试纸呈红色;
②取适量X溶液,加入过量的Ba(NO3)2溶液,得澄清透明的溶液A,并放出一种无色无味的气体B;
③向溶液A中加入过量的NaOH溶液,微热,放出一种刺激性气味的气体C,同时产生红褐色沉淀D,过滤得溶液F;
④向F溶液中通入过量的CO2,有白色沉淀生成。
请回答:
(1) D的化学式为: ;
(2) 检验气体C的方法__________________________________;
(3) 步骤②中反应的离子方程式为: ;
步骤④中反应的离子方程式为: ;
(4) X溶液中一定含有的离子是 ;不能确定是否含有的离子是 ,若要确定该离子(若不至一种,可任选一种)是否存在,最可靠的化学方法是 。
若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是g。
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为。
(2)写出该反应平衡常数K的表达式(a必须用具体的值表示)。
(3)下列说法中能说明该反应达到了化学平衡状态的是。
A:容器内压强一定 B:容器内气体的密度一定
C:容器内Z分子数一定 D:容器内气体的质量一定
(4)X的转化率α= (用含Q、Q1的代数式表示)。
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1kJ的是(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
(6)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ |
200 |
250 |
300 |
350 |
| 平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
试回答下列问题
(7)在300℃发生上述反应,以表中的物质的量投入到相同的恒容反应器中,其中向正反应方向转化的有(选填 A.B.C.D.E)。
| n(X) |
n(Y) |
n(Z) |
n(W) |
|
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
6 |
| D |
0.5 |
2 |
1 |
1 |
| E |
1 |
0.3 |
2 |
2 |
(8)若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为℃。
(9)在(8)小题达平衡后,保持温度和容器体积不变,分别向容器中再加入 A.2 mol X和1 mol Y, B.1mol Z和1 mol W, C.1molX , D.1 mol W至新平衡,则和原平衡相比,X的转化率A、B、C、D。(选填增大,减小,不变)
(10)维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则(选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数MN(选填>、<、=符号)。
含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO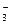 还原为N2,从而消除污染。其反应的离子方程式是:
还原为N2,从而消除污染。其反应的离子方程式是:
6NO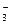 +10Al+18H2O=3N2↑+10Al(OH)3+6OH-
+10Al+18H2O=3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下11.2L氮气时,转移的电子为mol。现在要除去1m3含氮元素0.4mol的废水中的N0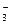 (设氮元素都以NO
(设氮元素都以NO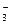 的形式存在,下同),则至少需要消耗金属铝g。
的形式存在,下同),则至少需要消耗金属铝g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为,若要除去1m3含氮元素0.3mol的废水中的NO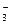 ,则至少需要含0.5%(质量分数)MgCl2的海水kg。
,则至少需要含0.5%(质量分数)MgCl2的海水kg。
有一种溶液,其中含有Ag+、Al3+、K+、Mg2+。
(1)向溶液中加入氯化钠溶液,现象为 。
(2)将实验(1)所得溶液过滤,向滤液中加入氢氧化钠溶液至过量,溶液中进行的反应的离子方程式有Mg2+ + 2OH¯= Mg(OH)2↓、Al3+ + 3OH¯=Al(OH)3↓和 。
(3)将实验(2)所得的溶液过滤,向滤液中加入过量的盐酸,产生的现象为 ,反应的离子方程式有H++OH¯=H2O、 、和Al(OH)3 + 3H+ =Al3+ + 3H2O
(4)检验溶液中有K+的方法是_________________,现象是______________________
研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是(填写符号)。
a.等体积等pH的醋酸和盐酸完全被NaOH溶液中和,消耗NaOH的物质的量一样多
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度比纯水的小
(2)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示: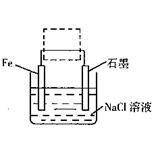
①写出石墨电极的电极反应式;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改。
③写出修改后石墨电极的电极反应式。
(3)①高炉炼铁过程中会发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)。
Fe(s)+CO2(g)。
已知:Fe(s)+1/2O2(g)=FeO(s)△H= -272kJ·mol-1
C(s)+O2(g)=CO2(g)△H= -393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H= -22lkJ·mol-1
则:①FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H=。
②一定温度下,向某密闭容器中加人足量FeO,
并充人一定量的CO气体,反应过程中CO和CO2的
浓度与时间的关系如图所示则从开始至达到平衡过程中, (CO)=。
(CO)=。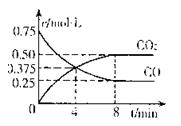
(4)铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为。