在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知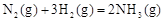
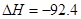 kJ·mol
kJ·mol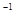 )
)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的浓度(mol·L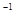 ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
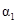 |
 |
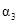 |
下列说法正确的是
A.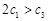 B.
B.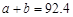 C.
C.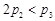 D.
D.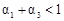
下列关于氧化还原反应说法正确的是
| A.同一反应中一种元素被氧化,肯定有另一种元素被还原 |
| B.某元素从化合态变成游离态,该元素一定被还原 |
| C.在反应中不一定所有元素的化合价都发生变化 |
| D.在氧化还原反应中非金属单质一定是氧化剂 |
下列说法中正确的是
| A.在一定温度和压强下,各种气态物质体积大小由构成气体分子大小决定 |
| B.在一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定 |
| C.不同的气体,若体积不同,则它们所含的分子数一定不同 |
| D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L |
已知丙酮是一种有机化合物,为无色液体,易溶于水,密度小于1 g/cm3,沸点约为55℃,要从丙酮和水的混合物中将丙酮分离出来,下列方法中最合理的是
| A.蒸馏 | B.分液 | C.过滤 | D.结晶 |
右图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指
| 饮用天然水理化指标 矿物元素测定结果 钙≥4.0 mg/L 镁≥0.5 mg/L 钾≥0.35 mg/L 钠≥0.8 mg/L 偏硅酸≥1.8 mg/L pH (25℃) 7.1
|
科学家在2000年8月10日出版的英国《自然》杂志上报告说,他们用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合.下列分散系中分散质的微粒直径与纳米粒子具有相同数量级的是
| A.溶液 | B.胶体 | C.悬浊液 | D.乳浊液 |