(4.5分)元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是依据元素周期表画出的1~18号元素的原子结构示意图。我对它进行研究:
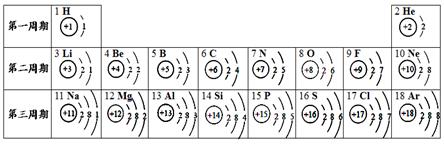
(1)原子序数为16的元素名称是 ,在化学反应中,该元素的原子容易 电子,变成 (填符号);原子序数为11的元素属于 (填“金属”或“非金属”)元素。
(2)根据图示信息,推测一个一氧化碳分子中所含的电子总数为 。
(3)我发现如下规律:①原子最外层电子数一般不超过8个;
②金属元素的原子最外层电子数一般少于4个,非金属元素的原子原子最外层电子数一般多于4个;
③ ;
④ ;
(4)右图表示碘元素的 (填“原子”、“阳离子”或“阴离子”)结构示意图。由图  可知,碘元素应位于元素周期表中的第 周期。
可知,碘元素应位于元素周期表中的第 周期。
实验室按下图所示装置制取CO2,并检验CO2的性质。试回答以下问题: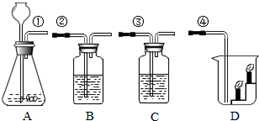
(1)写出组成装置A的一种玻璃仪器的名称: 。实验开始前,先应检查装置A的 。
(2)装置A制取CO2反应的表达式为 。
(3)若要用装置B检验CO2,在B中应盛放的药品是 。
(4)若要证明CO2 能与水反应生成碳酸,装置C中除有少量水外,应加入的药品是 ,当将标①和③的导管口连接时,C中看到的实验现象是 。
(5)烧杯D中放有燃着的蜡烛如图所示,当将标①和④的导管口连接时,D中看到的实验现象是 。
从宏观和微观的角度认识生活中的变化与现象是化学学科的特有思维方式。
(1)从微观的角度认识化学变化有助于理解反应的实质。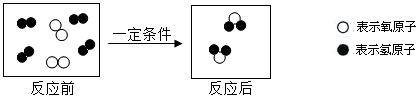
上图为氢气燃烧生成水的微观示意图,据图回答下列问题:
①写出图中化学反应的表达式 ,该反应属于 (“化合”或“分解”)反应。
②从宏观上看,水是由 组成;从微观上看水分子是由 构成。
③从原子、分子的角度分析,在化学反应过程中, 可分,而 不能再分。
(2)用微粒的观点解释。
①墙里开花墙外香的原因是 。
②用注射器抽取一些空气后堵住气口,推动活塞,体积变小的原因是 。
自来水是我国目前主要生活饮用水,如表是我国的饮用水水质标准的内容。
(1)自来水中的游离氯有少量可转变成氯离子,氯离子的符号是 ,
自来水的主要成分是水,请你用化学符号表示:2个水分子 。
(2)表格中的感官指标表现的是自来水的 (填“物理”或“化学”)性质,自来水属于 (填“纯净物”或“混合物”)。
(3)在下列净化水的操作中,可以降低水的硬度的是 。
a、吸附 b、沉淀 c、过滤 d、蒸馏
(4)在天然水净化过程中,人们常用活性炭去除异味和色素。这是利用活性炭的 作用。此外还需消毒杀菌,ClO2可用于消毒,ClO2中氯元素的化合价为 价。
化学源于生活,生活中蕴含着许多化学知识。请按照要求完成填空:
(1)医生抢救危重病人常用的气体是 ,因为该气体具有的化学性质是 。
(2)因为氮气的化学性质 (填“活泼”或“稳定”),所以充入食品包装袋内用于防腐。
(3)硬水洗涤衣物,既浪费肥皂也洗不净衣物,时间长了还会使衣物变硬。我们可以用 来区分硬水和软水。
(4)请写出二氧化碳的一种用途 。工业上制取二氧化碳,是利用高温煅烧石灰石,使石灰石中的碳酸钙分解,制得氧化钙和二氧化碳,该反应的表达式为 。
根据下列装置图回答问题: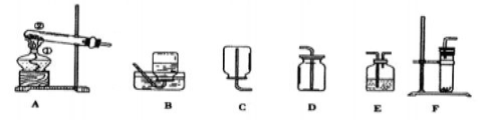
(1)写出仪器名称:① 、② 。
(2)从A~F中选择仪器装置:实验室用氯酸钾和二氧化锰制取较纯净氧气的实验装置是 ,发生反应的文字表达式为:________
(3)排水法收集氧气时,何时收集最理想: ___,集满氧气的集气瓶应__ __(“正立”或“倒立”)放在桌子上。
(4)实验室用大理石和稀盐酸反应制取二氧化碳,应选用实验装置是__ _ 。检验集气瓶中是否为二氧化碳的方法 ________________________。
(5)实验室用硫化亚铁和稀硫酸来制取硫化氢气体,硫化氢气体能溶于水,且密度比空气的大。则选用的气体实验装置是__ _______。