某溶液中含K+、Al3+、NH4+、SO42-。取500mL该溶液加入过量的氢氧化钡溶液,经过滤、洗涤、干燥,称重得到9.32g固体1,并收集到224mL(标准状况)气体。在滤液中通入过量的CO2, 经过滤、洗涤、灼烧,称重得到0.51g固体2。原溶液中K+的浓度为
| A.0.08mol/L | B.0.04mol/L |
| C.0.02mol/L | D.0.01mol/L |
一定能在下列溶液中大量共存的离子组是
①能使甲基橙变黄色的溶液:Na+、S2-、Cl—、SO32-
②室温,溶液中水电离出的H+、OH—浓度的乘积为10-28:Na+、NO3—、Mg2+、K+
③无色溶液:AlO2—、Na+、HCO3—、Mg2+
④澄清透明的溶液,溶液中c(H+)=10-2mol/L的溶液中:Cu2+、Na+、SO42—、Cl—
⑤在加入Al能放出大量气体的溶液中:Na+、Ba2+、NO3-、Cl-
⑥无色溶液:Cr3+、NO3-、Na+、Cl-、NH4+
| A.①④⑤ | B.②③④ | C.④⑥ | D.④⑤ |
提纯下列物质方法正确的是
| A.甲烷中混有乙烯(酸性KMnO4溶液,洗气) |
| B.硝酸钾中混有少量氯化钠(溶解,蒸发结晶) |
| C.提纯蛋白质(硫酸钠溶液,盐析) |
| D.(饱和碳酸氢钠,分液) |
下列4组实验操作或装置图(略去部分夹持仪器)中,有错误的图为几个
下列离子方程式书写正确的是
A.以石墨为电极电解MgCl2溶液:2Cl—+2H2O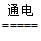 Cl2+H2↑+2OH— Cl2+H2↑+2OH— |
| B.强碱溶液中NaClO与Fe(OH)3反应:3ClO—+2Fe(OH)3=2FeO42—+3Cl—+H2O+4H+ |
| C.Na2CO3溶液与少量AlCl3溶液反应:3CO32-+Al3++3H2O=3HCO3-+Al(OH)3↓ |
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2OH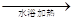 CH3COO-+NH4++3NH3+2Ag↓+H2O CH3COO-+NH4++3NH3+2Ag↓+H2O |
长式周期表共有18个纵行,从左到右排为1—18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
| A.第9列元素中没有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns 2 |
| C.第四周期第9列元素是铁元素 |
| D.第10、11列为ds区 |