实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
| A.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 |
| B.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 |
| C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl |
| D.称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| A.煤经过气化和液化两个物理变化,可变为清洁能源 |
| B.新型生物柴油和矿物油主要化学成分相同 |
| C.“洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 |
| D.用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
单质碳和氧化铜在一定温度下反应时,氧化铜可被还原为Cu2O、Cu。现将2.00gC与16.0gCuO的混合物,隔绝空气加热一段时间后,将生成的气体通过足量的澄淸石灰水,共收集到1.12L气体(标准状况),生成沉淀的质量为5.00g。下列说法错误的是
| A.反应后的固体混合物中还含有碳。 |
| B.反应后的固体混合物中Cu的质量为12.8 g。 |
| C.反应后的固体混合物总质量为14.4 g。 |
| D.反应后的固体混合物中氧化物的物质的量为0.05mol。 |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(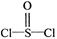 )中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是
)中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是
| A.电解质溶液中混入水,对电池反应无影响。 |
| B.金属锂作电池的正极,石墨作电池的负极。 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3。 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:l。 |
某密闭容器中存在2NO+O2 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
| A.该反应的正反应是吸热反应。 |
| B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。 |
| C.T1时,当反应处于D点,则该反应的逆反应速率大于正反应速率。 |
| D.如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的曲线在原曲线上方。 |
将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是
| A.NaOH溶液的物质的量浓度为0.1 mol/L,体积为1 L。 |
| B.M、N点离子浓度的都是c(HCO3-)>c(CO32-)。 |
| C.V=3.36 L时,溶液中的离子浓度关系是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。 |
| D.曲线上任意点都符合:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)。 |