选修:化学与技术】(海水是巨大的资源宝库,利用海水提取食盐的过程如图所示。回答下列问题:
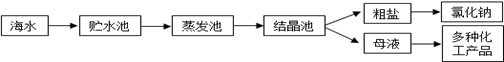
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:
| A.盐酸 | B.BaCl2溶液 | C.NaOH溶液 | D.Na2CO3.溶液。 |
加入试剂的顺序是 ______。
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为 ______,与电源负极相连的电极附近溶液pH的变化是 。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,则气体B是 (填化学式),由NaCl制取纯碱反应的化学方程为_______ 、______ ___。
(3)海水提镁的一段工艺流程如图:
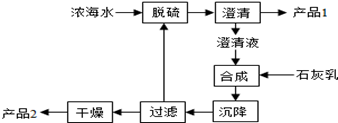
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/(g•L-1) |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ______,1 L浓海水最多可得到产品2的物质的量为 mol。
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH=.
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为:

(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强,(填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
| A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。 |
| B.Fe2+是4-CP降解反应的催化剂 |
| C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。 |
| D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。 |
③当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解的平均反应速率的计算表达式为。
已知: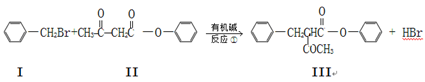
Ⅴ由化合物Ⅲ合成:
请回答下列问题:
(1)化合物Ⅱ的分子式为,Ⅲ的含氧官能团的名称为。
(2)反应①~③中,属于加成反应的是 ____________。
(3)化合物II与足量的H2(Ni作催化剂)加成后再在酸性条件下水解,所得产物之一可以发生聚合反应,写出该聚合产物的结构简式为:______________________________。
(4)1 mol化合物Ⅱ与C9H8的混合物完全燃烧时消耗O2的量为__________mol。
(5)化合物II与NaOH溶液能很快完全反应,写出该反应方程式:。
(6)化合物II也能发生类似反应②的反应得到一种分子中含3个碳原子的有机物,该物质的结构简式为。
(7)写出满足下列条件的IV的同分异构体的结构简式。
①苯环上只有两个处于对位的取代基; ②能发生银镜反应;③核磁共振氢谱有5组吸收峰
已知有机物A~I之间的转化关系如图所示:
①A与D、B与E、I与F互为同分异构体。
②加热条件下新制Cu(OH)2悬浊液分别加入到有机物I、F中,I中无明显现象,F中变砖红色。
③C的最简式与乙炔相同,且相对分子质量为104。
④B的一种同分异构体与FeCl3发生显色反应。
根据以上信息,回答下列问题:
(1) C E中含有的官能团名称分别为______ ________,
(2) H 的结构简式为________________________。
(3)反应①~⑨中属于取代反应的是____________________________。
(4)写出反应⑥的化学方程式_______________。
(5)写出F与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(6)苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3发生显色反应的G的同分异构体有________种。
有a、b、c、d、f五种前四周期元素,原子序数依次增大,a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b)且其中基态b原子的2p轨道处半充满状态,已知bc2+与ac2互为等电子体,d为周期表前四周期中电负性最小的元素,f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号)
(1)写出bc2+的电子式__________,基态f原子的核外电子排布式为___________。
(2)b的简单氢化物极易溶于c的简单氢化物,其主要原因是。
(3)化合物甲由c、d两种元素组成,其晶胞如甲图,甲的化学式___________。
(4)化合物乙的部分结构如乙图,乙由a、b两元素组成,硬度超过金刚石。①乙的晶体类型为________________________,其硬度超过金刚石的原因是_________________________。
②乙的晶体中a、b两种元素原子的杂化方式均为___________________。
最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如图: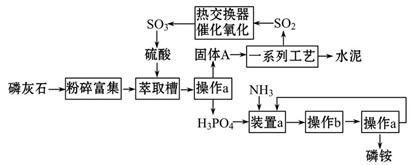
回答下列问题:
(1)操作a的名称是___________,实验室中进行此操作的非玻璃仪器或用品有________________;在实验室中操作b的名称是______________________。
(2)装置a中生成两种酸式盐,它们的化学式分别是_______________。
(3)依题意猜测固体A中一定含有的物质的化学式是____________________(结晶水部分不写)。
(4)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是___________________。
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀硫酸 |
| C.碘水、淀粉溶液 | D.氨水、酚酞试液 |