铜及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。
为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,请完成下列离子方程式:
Cu2S+ MnO4-+
MnO4-+ H+
H+
 Cu2++
Cu2++ SO42-+
SO42-+ Mn2++
Mn2++ H2O
H2O
(2)现有一块含有铜绿[Cu2(OH)2CO3]
的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。①固态铜与适量氧气反应,能量变化如图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式
②上述铜片中铜的生锈率为
(15分)【化学—选修化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸: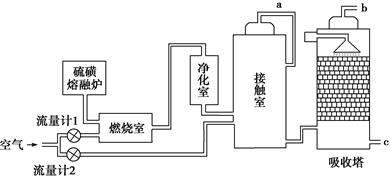
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式______________________________。
(14分)硝酸厂废气、汽车尾气中的氮氧化物可污染大气,现有几种消除氮氧化物的方法如下:
目前,消除氮氧化物污染有多种方法。
(1)方法一:CH4催化还原法。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44 kJ·mol-1
现有一混合气体中NO与NO2的体积比为3:1,用22.4L(标准状况下)甲烷气体催化还原该混合气体,恰好完全反应(已知生成物全部为气态),并放出1042.8KJ的热量,则ΔH2为_____________;写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O(l)的热化学方程式_________________________。
(2)方法二:活性炭还原法。
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,只生成甲和乙,甲和乙均为参与大气循环的气体,且反应进行到不同时间测得各物质的浓度如下: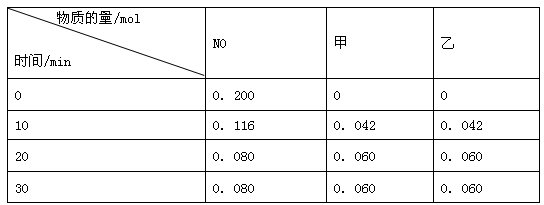
由以上信息可知:
①该原理的化学方程式为____________________________________________________.
②该温度下的平衡常数K=_____________________________。(保留小数点后两位有效数字)
③若20min后升高温度至T2℃,达到平衡后,若容器中NO、甲、乙的浓度之比为1:1:1,则该反应的ΔH_____0 。(填">"、"<"、"=")
(3)方法三:NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。
反应原理为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) 每生成1molN2转移的电子数为_____________________________________________________________。
2N2(g)+3H2O(g) 每生成1molN2转移的电子数为_____________________________________________________________。
(4)方法四:ClO2氧化氮氧化物。其转化流程如下: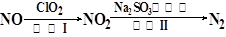
已知反应Ⅰ的化学方程式为2NO+ ClO2+ H2O = NO2+ HNO3+ HCl,则反应Ⅱ的化学方程式是。
工业废水中常含有一定量的Cr2O,会对人类及生态系统产生很大损害,电解法是行之有效的除去铬的方法之一。该法用Fe和石墨作电极电解含Cr2O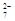 的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。
的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。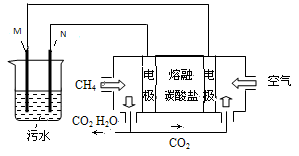
(1)Fe电极为(填“M”或“N”);电解时(填“能”或“不能”)否用Cu电极来代替Fe电极,理由是。
(2)阳极附近溶液中,发生反应的离子方程式是
阴极附近的沉淀有。
(3)图中熔融盐燃料电池是以熔融碳酸盐为电解质、CH4为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。已知,该熔融盐电池的负极的电极反应是CH4–8e–+4CO32–==5CO2+2H2O,则正极的电极反应式为。
(4)实验过程中,若电解池阴极材料质量不变,产生4.48L(标准状况)气体时,熔融盐燃料电池消耗CH4的体积为L(标准状况)。
甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH ="a" KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH ="b" KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式:。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)=_。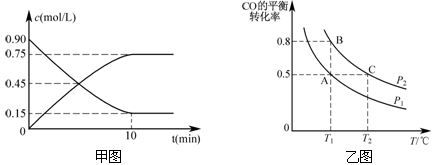
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)=L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是。
乳酸分子式为C3H6O3,在一定的条件下可发生许多化学反应,下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物。(已知—OH,—COOH等为亲水基团,F常做内燃机的抗冻剂)请回答相关问题:
(1)推断C、F的结构简式。C:;F:。
(2)B中所含的官能团名称为;反应③的反应类型是。
(3)反应①的化学方程式为。