氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2 的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用右图装置对煅烧产生的气体进行分步检验或收集。

①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答: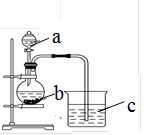
(1)仪器a的名称是,应盛放下列药品中的(填序号)。
A.稀硫酸 B. 亚硫酸 C. 氢硫酸 D. 盐酸
(2)仪器b应盛放下列药品中的(填序号)。
A.碳酸钙 B. 硫酸钠 C. 氯化钠D. 碳酸钠
(3)b中反应的离子方程式为。
若看到仪器C中的现象是,即可证明 比酸性强(填化学式),得电子的能力比强。
某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数,设计了下列四种实验方案:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)称取mg样品放入坩埚中充分加热。坩埚中发生反应的化学方程式为:
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热、冷却、称量”操作多次,其目的是:。
方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol/LHCl溶液滴定至终点,消耗0.1mol/LHCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol/LHCl溶液V2mL。则该样品中碳酸钠的质量分数为:。
方案三:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解后滴加足量氯化钙溶液。将反应混和物过滤后的下一步操作是:,沉淀经干燥后称量为m2g。
(2)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,_______测定样品中的Na2CO3的质量分数。(填“能”或“不能”)
方案四:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用如图装置,C中盛放的物质是。
(2)反应前后都要通入N2,反应后通入N2的目的是: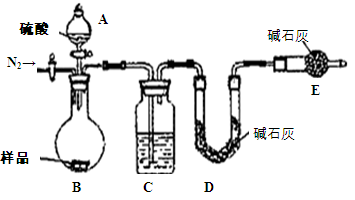
实验室用MnO2和浓盐酸制取氯气并验证氯气的部分性质,实验装置如下图所示。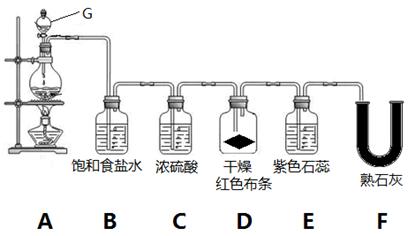
(1)G装置名称___________________。A装置的离子反应化学方程式是,氧化剂与还原剂的物质的量之比为。
(2)B装置的作用是_____________。
(3)实验开始几分钟后,D装置红布条是否褪色__________,E装置中观察到的现象是_____________
_____________________________________________________________。
(4)装置F中发生反应的化学方程式是_____________________________________________________。(5)F装置后应再连接一个尾气处理装置,装置里加入NaOH溶液,尾气处理的离子反应方程式为_____
____________________________________________________。
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。
请回答:
(1)装置A中用于添加浓硫酸的仪器名称为。
(2)实验前鼓入N2的目的是。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是。
②按观点2,装置B中反应的离子方程式是,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)。
| A.1 mol/L稀硝酸 |
| B.1.5 mol/L Fe(NO3)2溶液 |
| C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
| D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,进行如下实验: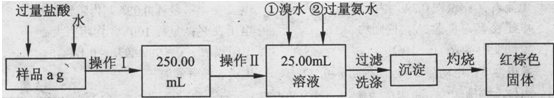
Ⅰ.甲同学根据如下流程进行实验,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式。
(3)将沉淀物置于坩埚中加热至恒重后,冷却至室温,称量剩余固体和坩埚的质量,计算。
实验中加热至恒重的目的是。
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是。
Ⅱ.乙同学提出,还可以采用以下方法来测定: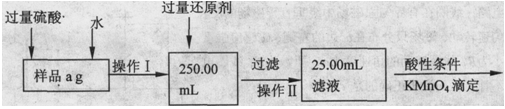
(1)溶解样品改用了硫酸,用离子方程式指明不再用盐酸原因是;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是;
(3)若滴定用掉c mol/L KMn04溶液b mL,则样品中铁元素的质量分数是。