某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答: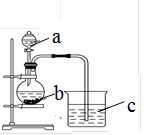
(1)仪器a的名称是 ,应盛放下列药品中的 (填序号)。
A.稀硫酸 B. 亚硫酸 C. 氢硫酸 D. 盐酸
(2)仪器b应盛放下列药品中的 (填序号)。
A.碳酸钙 B. 硫酸钠 C. 氯化钠 D. 碳酸钠
(3)b中反应的离子方程式为 。
若看到仪器C中的现象是 ,即可证明 比 酸性强(填化学式),得电子的能力 比 强。
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下: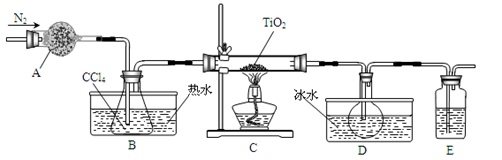
有关物质性质如下表
| 物质 |
熔点/℃ |
沸点/℃ |
其他 |
| CCl4 |
-23 |
76 |
与TiCl4互溶 |
| TiCl4 |
-25 |
136 |
遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解 TiOSO4(aq)+ 2H2O(l)== H2TiO3(s)+H2SO4(aq)
简要工艺流程如下: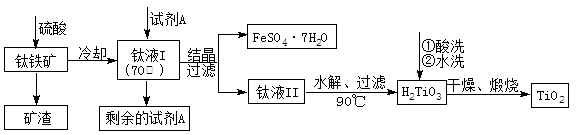
①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
(2014届北京市怀柔区高三第二学期适应性练习理综化学试卷)
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下: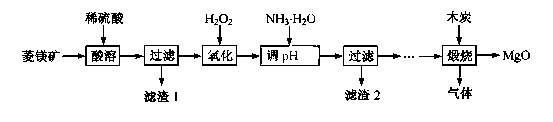
生成氢氧化物沉淀的pH
| Mg(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
9.4 |
6.3 |
1.5 |
| 完全沉淀时 |
12.4 |
8.3 |
2.8 |
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加氨水调节溶液的PH范围为 。
(3)滤渣2 的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 8000C 2MgO+2SO2↑+CO2↑
MgSO4+C 8000C MgO+SO2↑+CO↑
MgSO4+3C 8000C MgO+S↓+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体是 (填化学式)。
②B中盛放的溶液是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硫酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
(届山东省烟台市高三3月模拟化学试卷)
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时(填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时(填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
(届上海市十三校高三测试化学试卷)
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
请回答下列问题:
(1)写出反应Ⅰ中有电子转移的化学方程式_________________________;
(2)反应Ⅱ加入碳酸钙的作用是_______________;
(3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由 ____________;
(4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至________出现时,就可停止该操作。
(5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处。这种相似性称为对角线规则。步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是___________。
(6)请设计一种从水洗后的矿泥中分离出Al2O3的流程:
(流程常用的表示方式为: )
)
(届广东省江门市高三一模理综化学试卷)
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是。
(2)步骤②中,为提高浸出率,可采取的措施有。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)从水浸后的滤液中得到K2SO4晶体的方法是。
(4)步骤③电解的化学方程式是,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为吨(列出计算表达式)。