废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收二氯化锰。将废旧锌锰电池处理,得到含MnO(OH)混合物,向该混合物加入浓盐酸并加热,试写出MnO(OH)与浓盐酸反应的化学方程式: 。
(2)制备锰锌铁氧体。锰锌铁氧体可用作隐形飞机吸收雷达波的涂料。一种以锌锰废电池为原料制备锰锌铁氧体的主要流程如下:
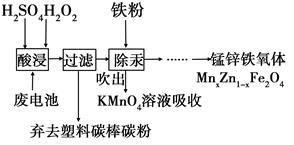
除汞时,铁粉的作用是______________ _(填“氧化剂”或“还原剂”或“吸附剂”);MnxZn1-xFe2O4中Fe元素为+3价,则Mn元素的化合价为 。
(3)在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如下图。

据图说明pH对Hg吸收率的影响规律 ;在强酸性环境下Hg的吸收率高的原因可能是 。
(4)锰回收新方法。向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为:2MnO(OH)+ MnO2+2H2C2O4 +3H2SO4 = 3MnSO4+ 4CO2↑+6H2O
①每1molMnO2参加反应时,共有 mol电子发生转移。
②新方法的优点是 (答1点即可)。
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。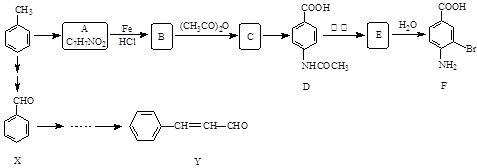
已知: 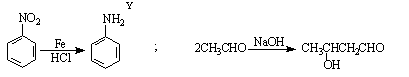
请回答下列问题:
(1)下列说法正确的是。
| A.F的分子式是C7H7NO2Br |
| B.甲苯的一氯取代物有3种 |
| C.F能发生取代反应和缩聚反应 |
| D.1mol 的D最多可以和5 mol H2发生加成反应 |
(2)D→E的反应类型是。
(3)B→C的化学方程式是。在合成F的过程中,B→C步骤不能省略,理由是。
(4)C→D反应所需的试剂是。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出3个)。
①苯环上只有两种不同化学环境的氢原子②分子中含有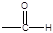
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: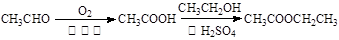
分子筛具有吸附能力强,热稳定性高等优良性能,使得分子筛获得广泛应用,某种型号分子筛的工业生产流程可表示如下:
在滴加氨水调节pH=9的过程中,若pH控制不当,会有Al(OH)3生成,假设生产过程中铝元素、硅元素均没有损失,钠原子利用率为10%。
(1)分子筛的直径为4A(1A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得6A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用_______型分子筛。
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为________________________
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要还有等离子。检验其中金属阳离子的操作方法是;
(4)加NH3•H2O调节pH后,加热到90℃并趁热过滤的原因可能是。
(5)该生产流程中所得分子筛的化学式为。(用氧化物形式表示)
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式: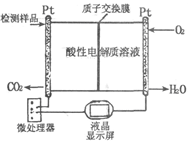
负极,正极。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。(填序号)
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为。
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有(填化学式),加入CO3(PO4)2的目的是。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为:。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
①AB段:;
②BC段。
Grignard试剂(卤代烃基镁)广泛运用于有机合成中,Grignard试剂的合成方法是:RX+Mg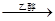 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇: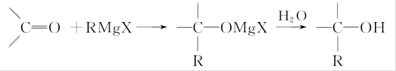
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性。合成线路如下:
请按要求填空:
(1)用系统命名法对物质B进行命名:;
(2)在I-J过程中所加入的二元酸的结构简式为:;
(3)反应①~⑧中属于取代反应的有个;属于消去反应的有个.
| A.1个 | B.2个 | C.3个 | D.4个 |
(4)写出下列过程的反应方程式(有机物请用结构简式表示):
B→D;
I→J;
(5)写出一种满足以下条件的D的同分异构体的结构简式。
①能与Na反应反出H2;②核磁共振氢谱有四组峰;③有二种官能团。(注:羟基不能与碳碳双键中的碳原子直接相连)