在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需要117 kJ ·mol-1~125 kJ ·mol-1 的热量,但1,3-环己二烯失去2个氢原子形成苯是放热反应,反应热是23.4 kJ ·mol-1 ,这表明
| A.苯比1,3-环己二烯稳定 | B.苯加氢生成环己烷是吸热反应 |
| C.1,3-环己二烯比环己烷稳定 | D.1,3-环己二烯加氢是吸热反应 |
已知热化学方程式H2 (g) + F2 (g) ="==" 2 HF (g) △H = -270 kJ· mol-1,下列说法中错误的是
| A.在上述条件下,44.8 L氟化氢气体分解成22.4 L氢气与22.4 L氟气吸收270 kJ热量 |
| B.在上述条件下,1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出热量大于270 kJ |
| C.在上述条件下,1 mol氢气与 1 mol氟气的能量总和大于 2 mol氟化氢气体的能量 |
| D.上述热化学方程式还可表示为:1/2 H2 (g) +1/2 F2 (g)="==" HF (g) △H = -135 kJ· mol-1 |
COCl2(g)  CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施能提高COCl2转化率的是
| A.恒容通入惰性气体 | B.恒压时通入惰性气体 |
| C.恒容通入COCl2气体 | D.加催化剂 |
足量的镁与一定质量的盐酸反应,由于反应速率太快,若要减慢反应速率,但不能影响产生氢气的总质量,可以加入的物质是
| A.CuSO4 | B.NaOH | C.K2CO3 | D.CH3COONa |
下列各装置中都盛有0.1 mol·Lˉ1的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是 
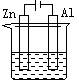
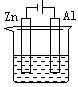
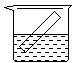
① ②③ ④
| A.③①④② | B.①②④③ | C.①②③④ | D.②①④③ |