在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w=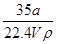 ×100% ②c=
×100% ②c=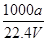
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
④向上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)> c(NH4+)>c(H+)>c(OH-)
| A.①③ | B.②③ | C.②④ | D.①④ |
坏血病患者应该多吃的食物是()
| A.水果和蔬菜 | B.鱼肉和猪肉 | C.鸡蛋和鸭蛋 | D.糙米和肝脏 |
甘氨酸和丙氨酸混合,在一定条件下,发生缩合反应生成二肽化合物共有()
| A.2种 | B.3种 | C.4种 | D.5种 |
利用蛋白质的变性可以为我们的日常生活,医疗卫生服务。
下列实例利用了蛋白质的变性的是()
①利用过氧乙酸对环境、物品进行消毒;②利用高温、紫外线
对医疗器械进行消毒;③蒸煮鸡蛋食用;④松花蛋的腌制;⑤用
蛋白质灌服重金属中毒的病人。
| A.全部 | B.①②③④ | C.①②③ | D.①② |
下列黄色不属于因化学反应而产生的现象的是()
A 无色试剂瓶中的浓硝酸呈黄色
B 久置的碘化钾溶液呈黄色
C 鸡蛋白遇浓硝酸呈黄色
D 在普通玻璃导管中点燃纯净氢气时火焰呈黄色
氯化钡有剧毒,致死量为0.3g,万一不慎误服,应大量吞服
鸡蛋清及适量解毒剂,此解毒剂是()
A AgNO3 B CuSO4 C MgSO4 D NA2CO3