4g NaOH溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液物质的量浓度是
| A.1mol/L | B.10mol/L | C.0.01mol/L | D.0.1mol/L |
T℃时,BaSO4在水中的溶解平衡曲线如图所示,下列说法正确的是()
[已知:Ba SO4 (s) Ba2+(aq)+ SO42—(aq)的平衡常数称为溶度积常数用Ks p表示,Ksp =c(Ba2+)·c(SO42—)]
Ba2+(aq)+ SO42—(aq)的平衡常数称为溶度积常数用Ks p表示,Ksp =c(Ba2+)·c(SO42—)]
| A.b点无Ba SO4沉淀生成 |
| B.加入BaCl2使溶液由d点变到c点 |
| C.加入Na2SO4使溶液由a点变到b点 |
| D.a点对应的Ksp大于c点对应的Ksp |
下列说法正确的是()
| A.已知:①C(s,石墨)+O2(g)=CO2(g) ;△H=" -393.5" kJ﹒mol-1,②C(s,金刚石) +O2(g)=CO2(g) ;△H= -395.0kJ﹒mol-1,则石墨比金刚石能量高,石墨比金刚石更稳定 |
B.已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ; △H 1,②CH3OH(g)+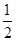 O2(g)= CO2(g)+2H2(g); △H2,则CH3OH(g)+ O2(g)= CO2(g)+2H2(g); △H2,则CH3OH(g)+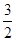 O2(g)= CO2(g)+2H2O(g) ;△H =" -" (3×△H2 - 2×△H1) O2(g)= CO2(g)+2H2O(g) ;△H =" -" (3×△H2 - 2×△H1) |
| C.已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则H2(g)+ Cl2 (g)=2HCl(g)的反应热△H = -[2×E3 - (E1+E2)] |
| D.已知:20℃时AgCl、Ag2S的溶解度分别是1.5×10-4 g 、1.3×10-16 g,则向1mL 0.1mol﹒L-1 AgNO3溶液中滴加NaCl溶液,再滴加Na2S溶液,只有白色沉淀生成 |
下列溶液中各微粒的浓度关系正确的是()
| A.0.1mol﹒L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B.0.1mol﹒L-1CuSO4溶液中:c(SO42-)> c(Cu2+)> c(OH-) > c(H+) |
| C.室温下,pH=2HCl溶液与pH=12氨水等体积混合后的溶液中:c(Cl-)>c(NH4+) |
| D.物质的量浓度相同的HCl溶液与氨水等体积混合后的溶液中:c(Cl-)= c(NH4+) |
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-1025kJ﹒mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
4NO(g)+6H2O(g) △H=-1025kJ﹒mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
25℃时,10mL0.1mol·L-1的一元酸HA溶液,在水中约有0.1%发生电离(每1000个HA只有1个HA电离),下列叙述不正确的是()
| A.该溶液的pH约是4 |
| B.HA一定是一种弱酸 |
| C.恰好中和时消耗NaOH的物质的量是10-6 mol |
| D.与足量Mg完全反应生成标准状况下气体的体积可能是11.2 mL |