常温时,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别是1.0×10-amol/L、1.0×10-bmol/L,这两种溶液的PH之和为
| A.14-a+b | B.14+a+b | C.14-a-b | D.14+a-b |
电解CuSO4溶液时,若必须达到以下三点要求:①阳极质量减少,②阴极质量增加,③电解液中c(Cu2+)不变。则可选用的电极是
| A.含Zn、Ag的铜合金作阳极,纯铜作阴极 |
| B.用纯铁作阳极,纯铜作阴极 |
| C.用石墨作阳极,惰性电极(Pt)作阴极 |
| D.用纯铜作阳极,含Zn、Ag的铜合金作阴极 |
有一化学平衡mA(g)+nB(g)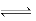 pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系。分析图中信息可以得出的结论是
pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系。分析图中信息可以得出的结论是
| A.正反应吸热,m+n>p+q |
| B.正反应吸热,m+n<p+q |
| C.正反应放热,m+n>p+q |
| D.正反应放热,m+n<p+q |
对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下到措施,有关叙述正确的是
| A.加入适量的氯化铵晶体后,两溶液的pH均减小 |
| B.温度降低10℃,两溶液的pH均不变 |
| C.分别加水稀释10倍,两溶液的pH仍相等 |
| D.分别用盐酸中和,消耗的盐酸体积相同 |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是
| A.正极反应式为O2+2H2O+4e一=4OH— |
| B.以网状的铂为正极,可增大与氧气的接触面积 |
| C.电池工作时,电流由铝电极沿导线流向铂电极 |
| D.该电池通常只需更换铝板就可继续使用 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+H2O(g)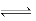 CO2(g)+H2(g)△H<O。反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g)+H2(g)△H<O。反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增加压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |