H2S溶于水的电离方程式为 。
(1)向H2S溶液中加入CuSO4溶液时,电离平衡向 (左或右,下同)移动,c(H+)_______,c(S2-)________。(填偏大、偏小、不变,下同)
(2)向H2S溶液中加入NaOH固体时,电离平衡向________移动,c(H+)_________,c(S2-)__________。
(3)若将H2S溶液加热至沸腾,c(H2S)____________。
2.36 g H2O和100 g D2O所含的氧原子数之比为______;分别与足量钠反应后,在标准状况下放出气体的体积比为_____;质量比为_____。
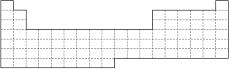
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的________族。
(3)第四周期有A、B、C、D四种元素,其最外层电子数依次为1、2、2、7,其原子序数按A、B、C、D的顺序增大,又已知A、B的次外层电子数为8,C、D的次外层电子数为18。请将A、B、C、D用元素符号填写在上面周期表中的对应位置上。
假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)根据每个周期最后一种金属元素出现的族序数,预测周期表中原子序数最大的金属元素将在________周期,________族(注:把0族看作ⅧA族)。周期表元素在填满________周期后将结束。
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看作非金属元素),预测周期表中应该有__________种非金属元素,还有__________种没发现。没发现的非金属元素处于__________周期__________族。
如右图所示,已知A元素的最低化合价为-3,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多一个。试完成下列问题:
(1)写出它们的元素符号:
A_________,B_________,C_________,D_________,E_________。
(2)它们的气态氢化物稳定性最弱的是_________。
(3)A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是_________。
现有A、B、C、D四种元素,A、B元素的原子各有两个电子层,C、D各有三个电子层;A与B能化合成无色、无味的气体AB2;1 mol C单质与0.5 mol D单质能形成离子化合物C2D;B和D同主族,B的离子和C的离子核外电子数相等。试推断这四种元素的名称。