K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6] 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
(1)K4[Fe(CN)6]中Fe2+的配位数为 (填数字);Fe2+基态核外电子排布式为 。
(2)(CN)2分子中碳原子杂化轨道类型为 ;1mol(CN)2分子中含有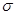 键的数目为 。
键的数目为 。
(3)O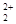 与CN
与CN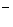 互为等电子体,则O
互为等电子体,则O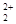 的电子式为 。
的电子式为 。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 。
海水提镁的工业流程如下
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
制造普通玻璃的主要原料是(写名称)_________、________、__________。
有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙烷在空气中燃烧 ②由乙炔制氯乙烯
③甲烷与氯气在光照的条件下反应 ④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯 ⑥乙烯使溴的四氯化碳溶液褪色
⑦实验室制乙烯 ⑧由甲苯制取TNT
⑨溴乙烷和氢氧化钠的乙醇溶液共热
⑩乙苯的制备:
(1)其中属于取代反应的是__________;属于氧化反应的是_________;属于加成反应的是_________;属于消去反应的是_________;属于聚合反应的是___________
(2)写出⑧和⑨的化学方程式:
⑧____________________________________
⑨____________________________________
某学习小组共同学习乙醛的化学性质,以下是他们的学习过程,请填空:
(1)根据乙醛的结构对性质进行预测
| 乙醛的结构特点 |
可能的化学性质 |
有 双键,不饱和 双键,不饱和 |
与H2发生 反应,乙醛表现 性 |
 CHO中C-H键极性较强 CHO中C-H键极性较强 |
 CHO中C—H键被氧化,变为C—OH CHO中C—H键被氧化,变为C—OH |
(2)写出乙醛与氢气反应的方程式
(3)设计实验验证乙醛的还原性,请填全表格。
| 实验 |
现象 |
结论 |
| 取适量乙醛溶液,滴加高锰酸钾酸性溶液 |
|
乙醛能被高锰酸钾氧化 |
| 向新制银氨溶液中加入几滴乙醛溶液,水浴加热 |
试管壁上出现 |
乙醛将银氨溶液还原 |
| 向新制氢氧化铜悬浊液中加入适量乙醛溶液,加热 |
|
乙醛被氢氧化铜氧化 |
根据上表及所学知识回答:
①乙醛被高锰酸钾溶液氧化为 (填结构简式)
②写出乙醛发生银镜反应的方程式
(4)某有机物只含C、H、O三种元素,该有机物对氢气的相对密度为15,完全燃烧 0.1mol该有机物生成4.4gCO2和1.8gH2O,该有机物的分子式为 ,若红外光谱显示该分子中有醛基,则3g该物质与足量的新制氢氧化铜反应,生成沉淀的质量为 g