世界卫生组织把铝列为食品污染源之一,每人每日的摄入量控制在0.004g以下。若在1kg米面食品中加入明矾2g(胆矾的化学式为KAl(SO4)2·12H2O,相对分子质量为474),请回答下列问题:
(1)KAl(SO4)2的相对分子质量= 。
(2)人从食物中摄入的铝指的是 (填字母)。
| A.铝元素 | B.铝单质 | C.铝合金 | D.只有明矾 |
(3)明矾中各元素的质量比K∶Al∶S∶O∶H= ;铝元素的质量分数为 (计算结果精确到0.1%)。
(4)如果某人一天吃了100g上述面食品,通过计算说明其摄入的铝的量是否超过安全摄入量?
工业上使用一种“渗铬(Cr)技术”可以大大提高钢铁制品的抗腐蚀能力。其中一个主要反应的化学方程式为Fe+CrCl2==Cr+FeCl2。已知参加反应的铁质量为28g,则生成铬的质量为多少克?
(6分)现有铜粉和镁粉的混合物样品,某兴趣小组要测定样品中镁的质量分数.他们称取该混合物样品10g置于烧杯中,然后加入350g溶质质量分数为7.3%的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如下图所示.请计算: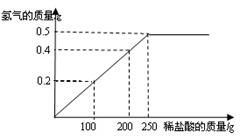
(1)原混合物样品中镁的质量分数是.
(2)要将剩余的稀盐酸完全反应掉,还需加入该样品的质量是多少?(简要写出计算过程)
实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液。需要氢氧化钠固体的质量为g。
(2)配制过程中除了用到天平、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是,
其作用是。
(3)用配得的氢氧化钠溶液与待测溶质质量分数的盐酸溶液反应,实验过程中溶液的pH变化曲线如图所示:
①要得到此变化曲线,所进行的操作是(填字母)。
A.将盐酸溶液滴加到氢氧化钠溶液中
B.将氢氧化钠溶液滴加到盐酸溶液中
②b点对应的溶液中的溶质为(写化学式)。
(4)恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,试计算该盐酸溶液中溶质的质量分数(请写出计算过程)。
.(10分)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(1)很多品牌牙膏都标有“含氟”字样,其中的“氟”是指
A.氟单质 B.氟元素 C.氟原子
(2)牙膏去污主要是利用了摩擦作用。某品牌牙膏中的摩擦剂是碳酸钙,为了检验并测定牙膏中碳酸钙的质量分数,同学们取了10g牙膏,加入足量稀盐酸并搅拌。实验过程中记录并处理数据形成下图曲线:
该品牌牙膏中碳酸钙的质量分数为多少。
(3)用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如下: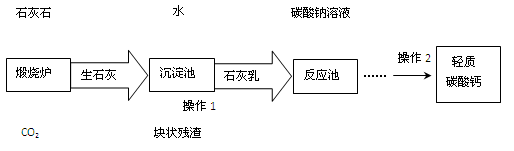
①“煅烧炉”中发生反应的化学方程式是: ,在“反应池”中主要发生反应的化学方程式是: 。
②“沉淀池”中生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆,熟石灰浆为
(选填“悬浊液”或“溶液”或“乳浊液”)。
③有人建议在上述流程中用CO2替代“碳酸钠溶液”。这样做的优点是 。
小王查阅资料后得知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应: CO2+Ca(OH)2=CaCO3↓+H2O, CaCO3+ H2O + CO2=Ca(HCO3)2;
|
b.碳酸氢钙微溶于水,微热易分解:Ca(HCO3)2="====" CaCO3↓+H2O+ CO2↑;
为了防止利用该法制得的轻质碳酸钙中混有Ca(HCO3)2,操作2中必需要进行的一步操作是 。课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3、还含有少量NaCl,其它杂质不计)和石灰乳(氢氧化钙的悬浊液)为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。
【粗产品制备】
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为。
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品。
【粗产品成分分析】
(1)取适量粗产品溶于水,加入Ba(NO3)2溶液出现白色浑浊,该反应的化学方程式为,由此该粗产品中一定不含有。
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质。
【含量测定】Na2CO3含量的测定
(1)该兴趣小组的同学设计了下图所示的实验装置。取20.0g粗产品,进行实验。 【说明】 ①碱石灰是CaO与NaOH的固体混合物。
【说明】 ①碱石灰是CaO与NaOH的固体混合物。
②CO2在饱和NaHCO3溶液中的溶解度非常小。
(2)操作步骤:
①连接好装置,检查气密性;将药品加入各装置
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量G的质量;
④关闭弹簧夹C,慢慢滴加浓盐酸,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;
⑥再次称量G的质量,得前后两次质量差为0.48g。
(3)问题探究:
①在用托盘天平称量粗产品时,如果天平的指针向右偏转,说明。
②B装置的作用是。
③在步骤②中,A处缓缓通入一段时间空气的目的是。
④若没有H装置,则测定的Na2CO3的质量分数会(填“偏大”、“偏小”、“不变”)。
⑤该兴趣小组指导老师认为该方案有些不合理,指导同学们更换了其中的一种试剂并去掉了一个装置后实验得到了完善,并测得20.0 g粗产品只能产生0.44 g CO2。你认为更换后的试剂是,原实验中实验值0.48g比正确值0.44 g偏大的原因是(假设操作均正确)。(4)数据计算:
根据正确值0.44 g,求得粗产品中Na2CO3的质量分数是(写出计算过程)。