对于反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
| A.只有硫酸铜作氧化剂 |
| B.SO42-既不是氧化产物又不是还原产物 |
| C.被氧化的硫与被还原的硫的质量比为3∶7 |
D.1 mol硫酸铜可以氧化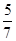 mol的硫 mol的硫 |
下列实验事实所得出的相应结论正确的是
| 实验事实 |
结论 |
|
| ① |
将木炭和浓硫酸反应生成的气体通入澄清石灰水中,有白色沉淀生成 |
该气体一定是CO2 |
| ② |
燃烧的镁条放入二氧化碳中能继续燃烧 |
还原性:Mg>C |
| ③ |
向某溶液中加入盐酸酸化的硝酸钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| ④ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液中一定有NH4+ |
A.①② B.③④ C.②④ D.①③
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g) 2XY3(g)△H=-92.6kJ·mol-1
2XY3(g)△H=-92.6kJ·mol-1
起始时各物质物质的量如下表所示:
| 容器 |
起始时各物质物质的量/mol |
||
| X2 |
Y2 |
XY3 |
|
| ① |
1 |
3 |
0 |
| ② |
0.6 |
1.8 |
0.8 |
达到平衡后,①容器中XY3的物质的量为0.5mol。下列叙述正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,容器②中XY3的物质的量浓度为2mol·L—1
C.容器①中反应达到平衡时放出的热量为23.15 kJ
D.容器②中反应达到平衡时放出热量
某元素的原子最外电子层排布是6s26p4,该元素或其化合物不可能具有的性质是
| A.该元素单质可能是导体 |
| B.该元素的最高化合价呈+6价 |
| C.该元素能与氢气反应生成气态氢化物 |
| D.该元素价电子轨道中有2个未成对电子 |
下列物质分类的正确组合是
| 分类 组合 |
纯净物 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
| A |
碱石灰 |
乙二酸 |
纯碱 |
氧化铝 |
二氧化碳 |
| B |
盐酸 |
石炭酸 |
小苏打 |
氧化镁 |
二氧化氮 |
| C |
H2O2 |
硬脂酸 |
苏打 |
过氧化钠 |
二氧化硫 |
| D |
五水硫酸铜 |
油酸 |
碱式碳酸铜 |
氧化钠 |
三氧化硫 |
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH4+)> c(SO42-)>c(Fe2+)>c(H+) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c (CH3COO-)> c (Na+)> c (H+)> c (OH-) |