已知25 ℃、101 kPa条件下:4Al(s)+3O2(g) 2Al2O3(s);ΔH="-2" 834.9 kJ·mol-1
2Al2O3(s);ΔH="-2" 834.9 kJ·mol-1
4Al(s)+2O3(g) 2Al2O3(s);ΔH="-3" 119.1 kJ·mol-1
2Al2O3(s);ΔH="-3" 119.1 kJ·mol-1
(1)、写出O3转化成O2的热化学方程式
(2)、2molO3的能量 3molO2的能量(填“>” “="”" “<”)
(3)、2molO3的键能 3molO2的键能(填“>” “="”" “<”)
(4)、稳定性O3 O2(填“>” “<”)
下列物质中(1)Na(2) Br2 (3)Na2O(4)NO2 (5)CO2 (6) SO3(7)NH3 (8)H2S(9)HCl (10)H2SO4 (11)Ba(OH)2 (12) NaCl(13)蔗糖(14)NaCl溶液。
属于电解质的是 , 属于非电解质的是 ,
能导电的是 。(用序号填写)
写出下列反应的离子方程式
(1)铝与氢氧化钾浓溶液反应
(2)向偏铝酸钠溶液中通过量二氧化碳
(3)向NaHSO4溶液中加入Ba(OH)2使溶液呈中性
(4)过氧化钠与稀食盐水反应
(5)碳酸氢钙与过量氢氧化钠反应
(6)向硝酸亚铁溶液中滴加盐酸
(1)(5分)由A、B两种气态烃组成的混合气体,对H2的相对密度为17。常温常压下,取这种混合气体10mL与80mL氧气(过量)混合,当完全燃烧后恢复到原状态时,测得气体的体积为70mL。试求:
①混合气体的平均组成为(用CxHy的形式表示)___________;
②若上述两种气体按体积1:1混合时,则两种气态烃的可能组成为______________。
(2)(5分)具有支链的化合物X的分子式为C4H8O,X既能使Br2的四氯化碳溶液褪色,又能与Na反应。
①X的结构简式是
②写出与X具有相同官能团的X的所有同分异构体的结构简式:_____________
【化学—选修2化学与技术】某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是__________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因________________。
(3)②中反应后无气体放出,该反应的离子方程式为___________________。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因______________________。
(12分)如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):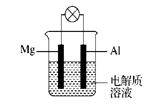
(1)电解质溶液为稀H2SO4时,灯泡(填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的 极;若灯泡不亮,其理由为 。
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Al做原电池的 极。若灯泡不亮,其理由为 。
(3)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:________________。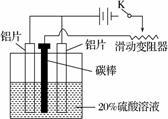
如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。