在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
| A.1.2mol | B.1.5mol | C.1.8mol | D.2.1mol |
共价键、离子键、范德华力和氢键是形成晶体的微粒之间的四种作用力。下列晶体:①Na2O2②固态氨 ③NaCl ④SiO2 ⑤冰 ⑥干冰,其中含有三种作用力的是
| A.①②③ | B.①②⑥ | C.②⑤ | D.⑤⑥ |
下图两个装置中,液体体积均为400 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得两池均有0.02 mol电子转移,若忽略溶液体积的变化,下列叙述正确的是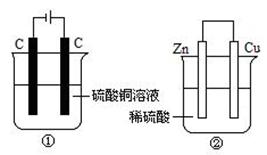
| A.②装置中硫酸根离子移向铜极 |
| B.①中阴极质量增加,②中正极质量减小 |
| C.产生气体的物质的量: ①=② |
| D.溶液的pH变化:①减小,②增大 |
下面是常见的电化学装置图,①③④中均为惰性电极,下列说法正确的是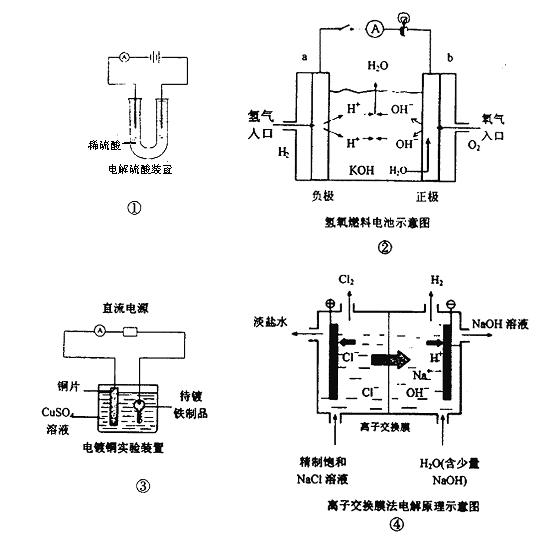
| A.装置①中电解一段时间后,溶液的PH不变。 |
| B.装置②中b极为正极,该极的电极反应方程式为O2+4H++ 4e-=2H2O |
| C.装置③中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol 电子转移,此时铜片和铁制品的质量差为128g |
| D.装置④中阳离子交换膜上每透过1mol Na+时,则阴极上产生11.2L H2 |
“暖宝宝”取暖片的材料中含有铁粉、水、硅石、食盐、等,它们组成一个原电池,在反应时释放出热量,铁粉在原电池中充当
| A.负极 | B.正极 | C.阴极 | D.阳极 |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔) =4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH  Fe3O4+2H2↑十4Na↑。下列有关说法正确的是d
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是d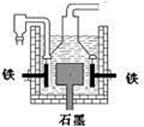
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |