下列仪器: ①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是
| A.①③④ | B.①②⑥ | C.①③⑤ | D.③④⑦ |
下列叙述正确的是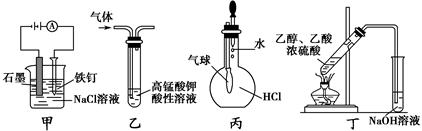
| A.装置甲可防止铁钉生锈 |
| B.装置乙可除去CO2中混有的SO2 |
| C.装置丙可验证HCl气体在水中的溶解性 |
| D.装置丁可用于实验室制取乙酸乙酯 |
下述实验不能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
将铜片分别与浓、稀硝酸反应 |
探究浓、稀硝酸氧化性的相对强弱 |
| B |
将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置 |
比较氯与溴的氧化性强弱 |
| C |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有漂白性 |
| D |
向盛有20 g蔗糖的烧杯中加入几滴水,搅拌均匀。再加入少许浓硫酸,迅速搅拌 |
探究浓硫酸的脱水性 |
下列实验能达到目的的是
| A.用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| B.将混有少量HCl的CO2通入饱和NaHCO3溶液中除去HCl |
C.测定等浓度的Na2CO3和Na2SO3 溶液的pH大小,可比较非金属性: |
| D.用AgNO3溶液鉴别Na2SO4溶液与NaCl溶液 |
下列陈述I、II正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
SO2和氯水有漂白性 |
两者都能使溴水褪色 |
| B |
用淀粉-KI鉴别FeCl2 |
Fe2+有氧化性 |
| C |
盐酸和氨水能溶解Al(OH)3 |
Al(OH)3是两性氢氧化物 |
| D |
CuSO4可以用作游泳池消毒剂 |
铜盐能使蛋白质变性 |
下列陈述Ⅰ、Ⅱ都正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
非金属性:Cl>S |
酸性:HClO> H2SO3 |
| B |
SO2有氧化性 |
SO2能使酸性KMnO4溶液褪色 |
| C |
NH3.H2O为一元弱碱 |
含有NH4+的水溶液均显弱碱性 |
| D |
锌的金属性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |