NA为阿伏加德罗常数,下列关于0.2mol/L K2SO4溶液的正确说法是
| A.500mL溶液中所含K+、SO42-总数为0.3NA |
| B.500mL溶液中含有0.1NA个K+离子 |
| C.1L溶液中K+离子浓度是0.2mol/L |
| D.2L溶液中SO42-离子浓度是0.4mol/L |
关于反应:14CuSO4+5FeS2+12H2O = 7Cu2S+ 5FeSO4 + 12H2SO
5FeSO4 + 12H2SO 4,下列说法正确的是
4,下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 | B.5mol FeS2发生反应,有10mol 电子转移 电子转移 |
| C.产物中的SO42--离子有一部分是氧化产物 | D.FeS2只作还原剂 |
下列离子方程式,正确的是
| A.SO2通入BaCl2溶液中:SO2 + H2O + Ba2+="=" BaSO3 + 2H+ |
| B.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+ |
| C.用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+==NO↑+I2+H2O |
| D.FeCl3溶液中加入CuO:2Fe3+ + 3CuO + 3H2O="=" 2Fe(OH)3 + 3Cu2+ |
同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是
| A.单质的化学活泼性:W<X<Y<Z | B.最外层电子数:W<X<Y<Z |
| C.单质的氧化能力:W<X<Y<Z | D.元素的最高化合价:W<X<Y<Z |
NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下,等体积的水和CO2,含有的氧原子数目为1∶2 |
| B.含有NA个阴离子的Na2O2与足量水反应,转移电子数为2NA |
| C.向FeI2溶液中通入适量氯气,当有NA个Fe2+被氧化时,共转移电子数为3NA |
| D.一个NO分子质量为a g,一个NO2分子质量是b g,则NA个O2的质量为(b—a)NAg |
下列有关化学用语表示正确的是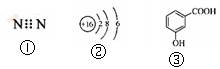
| A.右图中的①是N2的电子式 |
| B.右图中的②是S2-的结构示意图 |
| C.质子数为53,中子数为78的碘原子:13153I |
| D.右图中的③是邻羟基苯甲酸的结构简式 |