下表是元素周期表的一部分,表中列出了8种元素在周期表中的位置。请回答有关问题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
|
|
|
⑤ |
⑥ |
⑦ |
|
| 3 |
|
② |
④ |
|
|
|
|
| 4 |
① |
③ |
|
|
|
|
⑧ |
(1)写出元素⑧的基态原子核外电子排布式 ;
(2)元素⑤⑥⑦第一电离能由大到小的顺序是 (用电离能和元素符号表示);
(3)元素①、②、③对应的氧化物熔点由高到低的顺序排列是 (填化学式);
(4)元素③、②、④形成的单质晶体的熔点升高的原因是 。
有A、B、C、D、E五种烃,具有下列性质:①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是前三者的3倍;②在适宜条件下,A、B、C都能跟H2发生加成反应,其中A可以转化为D,B可以转化为C,C可以转化为E;③B和C都能使溴水或酸性KMnO4溶液褪色,而A、D、E无此性质;④用铁屑作催化剂时,A可与溴发生取代反应。
(1)写出B与D的结构简式B_______________ D_________________
(2)写出下列反应方程式
A与溴铁粉作催化剂反应:_________________________________
C转化成E:________________________
下图是元素周期表的框架图(未标出元素周期表的边界),请根据下面提问回答表中指定元素的相关问题:
| ① |
② |
③ |
|||||||||||||||
| ④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||||||||||||
| ⑨ |
⑩ |
||||||||||||||||
(1)表中化学性质最不活泼的元素,其原子结构示意图为。
(2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该两性氢氧化物与⑦的氢化物的水溶液反应的离子方程式。
(3)电子式表示④与⑦形成化合物的过程。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(填酸的化学式)。
(5)⑥、⑦、⑨电子数相等的简单离子的半径由大到小依次为(用元素符号表示)。
(6)④⑤两元素相比较,金属性较强的是(填名称),可以验证该结论的实验是(填编号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(1)在一定温度下,向1L体积固定的密闭容器中加入1mol A(g),发生反应2A(g) B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时是原来的2倍。
B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时是原来的2倍。
a.平衡常数 b. A的平衡浓度
c.平衡时混合气体的密度 d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡移动(填“向左”“向右”或“不”);若加入少量下列试剂中的,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4d.NaHSO3
e. CH3COOH
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol 的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为_____________
(4)已知:2Zn(s)+O2(g)=2ZnO(s)△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s)△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)△H=_____________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为 。
已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如下图所示,请按要求写出有关反应式,是离子反应的只写离子方程式。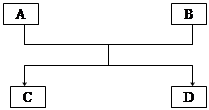
(1)若A、D的组成元素同主族:
①B是水
②B、C均为氧化物:
(2)若A、D的组成元素不同主族
①B是水且水是还原剂:
B是水且水是氧化剂
②B、C均为氧化物
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型是 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1mol CO2中含有的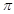 键数目为 。
键数目为 。
(3)向CuSO4溶液中加入过量的NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。