(1)在一定温度下,向1L体积固定的密闭容器中加入1mol A(g),发生反应2A(g) B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时 是原来的2倍。
B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时 是原来的2倍。
a.平衡常数 b. A的平衡浓度
c.平衡时混合气体的密度 d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
e. CH3COOH
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol 的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为_____________
(4)已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l) △H=_____________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为 。
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol·L﹣1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为;该溶液pH_______7(填“=”“>”或“<”)。
(2)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明________(填字母)
| A.该Na2S2O3溶液中水电离的c(OH﹣)=10﹣8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
| D.Na2S2O3水解方程式为S2O32﹣+2H2O=H2S2O3+2OH﹣ |
写出实验②发生反应的离子方程式。
(3)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O(摩尔质量为248g/mol)的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗KMnO4溶液体积20.00 mL。(已知:5S2O32﹣+8MnO4﹣+14H+=8Mn2++10SO42﹣+7H2O)。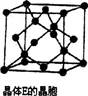
试回答:
①KMnO4溶液置于——(填“酸式”或“碱式”)滴定管中,滴定终点的现象为。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果_____________(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为。
有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,其中A、C元素的原子最外层电子数相同,且A、C可形成离子化合物,B、F同主族,且C、D、F最高价氧化物的水化物能两两相互反应生成盐和水,F的最外层电子数比C多6,E元素在地壳中的含量仅次于氧,请用化学用语回答下列问题:
(1)写出A、C两种元素组成的化合物的电子式:____________;
(2)B、F的氢化物沸点较高的为____________;
(3)C、D与氧元素形成的常见化合物的水溶液呈碱性,其原因是(用离子方程式表示)
(4)C、D、B按质量比为23:9:38组成一种化合物,化合物中含有的化学键类型有_______________;
(5)E可与氧元素通过共价键形成原子晶体,其晶胞可看作是在晶体E的晶胞中插入了_______个氧原子。
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:
查资料得知:
| 物质名称 |
溶度积(Ksp) |
pH值 |
|
| 开始沉淀 |
完全沉淀 |
||
| Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
| Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
| Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E;②溶液F生成固体G。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)=。
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。
回答下列问题:
(1) a是电源的极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数(填“变大”、“变小”、或“不变”)。
A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
A的基态原子最外层电子排布式为2s22p3 |
| B |
B是地壳中含量最高的元素 |
| C |
C+与B的简单离子的电子层结构相同 |
| D |
D的一种核素的质量数为64,中子数为35 |
| E 、F |
E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是;F原子的原子结构示意图为。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_______;与A2B互为等电子体的分子的分子式为(任写一个即可)。
(4)D晶体的晶胞如图所示为面心立方最密堆积 (在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为。
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为。