硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
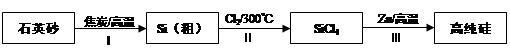
(1)硅元素位于元素周期表的第______________周期____________族。
(2)已知反应Ⅰ得到的粗硅中含有SiC,其中Si和SiC的物质的量之比为2∶1。写出制造粗硅时的反应方程式 。SiC熔融时不导电,工业上常用作耐火和高温炉的材料,由此推知,它属于____________晶体。
(3)因为SiCl4遇水剧烈水解生成SiO2和一种酸,所以整个制备过程必须严格控制无水条件。在干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是 。
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示, K值大小与温度的关系是:温度升高,K值_________________。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g)  CO2(g) +H2 (g)△H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
CO2(g) +H2 (g)△H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
①表中3min~4min之间反应处于_________状态;
c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min~6min之间数值发生变化,可能的原因是_________ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(1)①根据图示,写出反应的热化学方程式:。
②根据如图所示情况,判断下列说法中正确的是()
| A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ/mol |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.当H2O为液态时,其反应热值小于41 kJ/mol |
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:。
a、b两条曲线产生区别的原因很可能是。
、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 |
平衡移动方向 |
C(OH -) |
C(CH3COO -) |
| 升温 |
不填 |
不填 |
|
| 加水 |
不填 |
||
| 加盐酸 |
不填 |
||
| 加少量氢氧化钠固体 |
不填 |
不填 |
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
③a、b、c三点中醋酸的电离程度最大的是。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”),
根据强弱电解质的概念回答下列问题:
其中能够导电的是;属于强电解质的是;属于弱电解质的是;属于非电解质的是(注回答不全不给分)
从铝土矿(主要成分是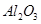 ,含
,含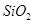 、
、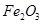 、MgO等杂质)中提取Al2O3的两种工艺品流程如下:
、MgO等杂质)中提取Al2O3的两种工艺品流程如下: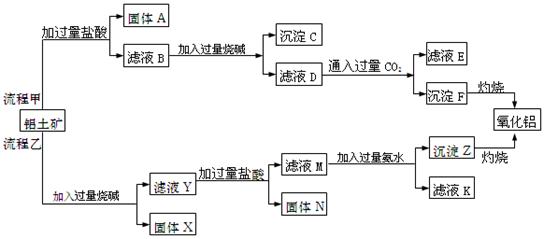
请回答下列问题:
(1)写出相应物质的的化学式:固体A,固体N,
滤液D中溶质为。
(2)流程甲加入盐酸后生成Al3+的离子方程式为。
(3)流程乙加入烧碱后生成水玻璃溶液的化学方程式为。