根据下图海水综合利用的工业流程图,判断下列说法正确的是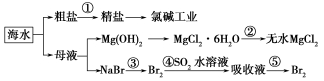
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
| D.从第③步到第④步的目的是为了浓缩富集溴 |
下列物质的转化在给定条件下能实现的是
①
②
③
④
⑤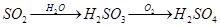
| A.①⑤ | B.②③ | C.②⑤ | D.③④ |
下列有关物质的性质与应用相对应的是
| A.二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 |
| B.K2FeO4具有还原性,可用于自来水的杀菌消毒 |
| C.浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸 |
| D.SO2具有漂白性,能使紫色KMnO4溶液褪色 |
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
| A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 |
| B.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
| C.漂白粉、福尔马林、冰水、王水、氯水均为混合物 |
| D.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
假设与猜想是科学探究的先导和价值所在。下列假设引导下的探究肯定没有意义的是
| A.探究SO2和Na2O2反应可能有Na2SO4生成 |
| B.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是CuO |
| C.探究Na与水的反应可能有O2生成 |
| D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致 |
人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是
| A.铁、金属活动性顺序表 | B.金、质量守恒定律 |
| C.银、元素周期律 | D.铜、金属密度顺序表 |