有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42﹣ HCO3﹣ NO3﹣ OH﹣ |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D .
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 .
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 .
(4)C常用作净水剂,用离子方程式表示其净水原理 .
过硫酸钾(K2S2O8)的氧化性强于KMnO4,某反应在银离子催化下可发生,该反应体系中的物质有:K2S2O8、、KMnO4、K2SO4 、 MnSO4、H2SO4、 H2O。
(1)请写出并配平上述反应的化学方程式:
(2)反应中被还原的物质是:;还原剂是:。
(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式__________________
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式_________________________
离子化合物M(化学式为NaN3)在汽车安全气囊中有重要的作用,M与其他物质的转化关系如下图所示。已知:常温下G为淡黄色固体,H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X分别为空气的主要成分之一。I、J为常见的工业原料。相关转化关系如图所示:☆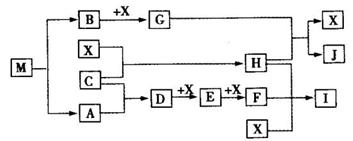
(1)实验室中物质I应如何保存?。
(2)写出D与X反应的化学方程式。
(3)G,F均能氧化SO2 ,若前一反应仅生成一种盐,后一反应生成两种氧化物,写出相应化学方程式;。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出a kJ的热量,写出M分解的热化学方程式。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。
(6)相同条件下,等体积等物质的量浓度的M溶液和NaCl溶液中,阴、阳离子总数的关系是前者后者.(填大于、等于或小于)
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见非金属元素,将A、C的水溶液混合可得B的沉淀
①A、B、C中含有的同一种常见非金属元素为___________。
②写出A、C的水溶液混合生成沉淀B的化学反应方程式
为。
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e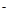 结构。
结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_____________ 。
。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是_____________。
②将过量X通入100mL 3 mol/L A的水溶液中,将所得溶液与明矾溶液混合,写出混合时反应的离子方程式___________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
(1)下图所示是实验室中制取气体的一种简易装置。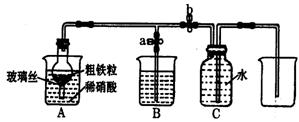
①甲同学用下列方法检验装置的气密性,请问能否达到目的(填能或否)
关闭止水夹a和b,从A处烧杯中加入水,使干燥管与烧杯中液面形成液面差,一段时间后,液面差没有变化,说明气密性良好。
②实验室利用上图所示发生装置可以制取下列气体。
| A.Cl2 | B.CO2 | C.H2S | D.SO2 |
(2)乙同学利用该图所示装置,用粗铁粒与3mol·L-1硝酸反应制取NO气体。请回答有关问题。
①NO气体能用排水法收集,而不能用排空气法收集的可能原因是。
②制取NO时,向A杯中加入稀硝酸,同时打开止水夹a,关闭止水夹b,A装置的干燥管中观察到气体的颜色的变化为。B装置烧杯中液体的作用是。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
③将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量为mol(用含b的代数式表示)。