关于如图所示装置的叙述正确的是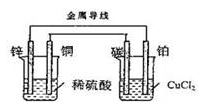
| A.电流由锌经导线流向铂,电子由铜经导线流向碳棒 |
| B.碳棒是正极,铜片是阳极 |
| C.锌片的质量逐渐减少,铂片的质量逐渐增加 |
| D.锌片上发生还原反应,碳棒上发生氧化反应 |
下列物质的水溶液能导电,但该物质属于非电解质的是
| A.CuSO4 | B.CO2 | C.HCl | D.CH3CH2OH |
下列电子式中错误的是
实验中的下列操作正确的是
| A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入试剂瓶中 |
| B.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| C.用蒸发方法使NaCl从溶液中析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热 |
| D.分液操作时,分液漏斗中下层液体从下端放出,上层液体也从下端放出 |
在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙 、硒、氟应理解为
、硒、氟应理解为
| A.元素 | B.单质 | C.分子 | D.氧化物 |
某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是

| A.用食醋除去暖水瓶中的薄层水垢 |
| B.用米汤检验食盐中是否含碘酸钾(KIO3) |
C.用纯碱(Na2CO3)溶液洗涤餐具 上的油污 上的油污 |
| D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |