(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为 ;
又知H2O(l)=H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ
(2)发射卫星时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成N2和水蒸气.又已知: ①N2(气)+2O2(气)=2NO2(气) △H=+67.7kJ/mol ②N2H4(气)+O2(气)=N2(气)+2H2O(气) △H=-534kJ/mol 试写出肼与NO2反应的热化学方程式:
(3)甲烷燃料电池:碱性电解质(铂为两极、电解液KOH溶液)
正极:___________ _____
负极:__________
总反应方程式: CH4+ 2O2 + 2OH- = CO32- + 3H2O
工.在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,
溶液中 (填“增大”、“减小”或“不变”);溶液中各微粒浓度由大到小的顺序为:_________
(填“增大”、“减小”或“不变”);溶液中各微粒浓度由大到小的顺序为:_________
(2)常温下,向20 ml0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHC1溶液40 mL,溶液中含碳元素的微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如下:
回答下列问题:
①所得溶液中含量最多的三种微粒的物质的量浓度的大小关系为
②已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=。
Ⅱ.金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O72-废水的方法如下:
(1)向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:。
(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L(已知25℃时,Ksp[Cr(OH) 3]=6.3×10-31)。
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度_______(单位:mg/L,写出计算过程)。 已知测定过程中发生的反应如下:
①2Cr3++3S2O32-+7H2O= Cr2O72-+6SO42-+14H+②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+ S2O32-= 2I-+ S4O62-
“雾霾”已成为当今世界环境热点话题,为减少CO、SO2、NOx等气体的排放,某环境小组研究使用如下方式。
Ⅰ.使用清洁能,例如二甲醚( DME)。现由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g)ΔH1=—90.7KJ/mol
CH3OH(g)ΔH1=—90.7KJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH2=—23.5KJ/mol
CH3OCH3(g)+H2O(g)ΔH2=—23.5KJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g) ΔH3=—41.2KJ/mol
CO2(g)+H2(g) ΔH3=—41.2KJ/mol
回答下列问题:
(1)则反应3CO(g)+3H2(g)  CH3OCH3(g)+ CO2(g) 的ΔH =______KJ/mol;
CH3OCH3(g)+ CO2(g) 的ΔH =______KJ/mol;
(2)将合成气以甲n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3 (g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是 (填字母序号)。
CH3OCH3 (g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是 (填字母序号)。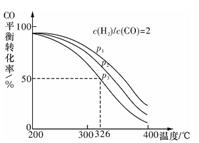
A.△H<O
B.P1< P2<p3
C.若在p3和316℃时,起始n(H2)/n( CO)= 3,则达到平衡时,CO的转化率小于50%
(3)如图为绿色“二甲醚燃料电池”的工作原理示意图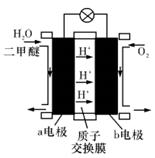
a电极的电极反应式为:
Ⅱ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 mol CO,测得CO2的体积分数
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 mol CO,测得CO2的体积分数 (CO2)随时间t变化曲线如图。
(CO2)随时间t变化曲线如图。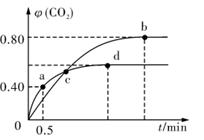
请回答:(1)从反应开始至a点时的反应速率为v(CO)。
(2)b点时化学平衡常数Kb=。
(3)下列说法不正确的是 (填字母序号)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.增大d点的体系压强,CO的转化率不变
D.b点和d点的化学平衡常数:Kb<Kd
将6mol A和5 mol B混合放入4L密闭容器中,在一定条件下发生反应:
3A (g) +B(g)  2C(g) + xD(g),经5 min达到平衡,此时C的浓度为0.5 mol·L-1,测得D的平均反应速率为0.15 mol·L-1·min-1,则平衡时A的物质的量浓度为,B的平均反应速率为,x的值为。
2C(g) + xD(g),经5 min达到平衡,此时C的浓度为0.5 mol·L-1,测得D的平均反应速率为0.15 mol·L-1·min-1,则平衡时A的物质的量浓度为,B的平均反应速率为,x的值为。
请回答下列问题:
(1)NH4Cl溶液显性,原因是(用离子方程式表示),NH4Cl溶液中离子浓度由大到小的顺序为。
(2)常温下,0.10 mol/L的CH3COOH溶液中,c(H+)0.10 mol/L(填“>”、“<”、“=”)。
CH3COOH在水溶液中的电离方程式为
(3)将浓度均为0.10 mol/L的CH3COOH溶液和NaOH溶液混合后,若pH>7,则该溶液中c(CH3COO-)___c(Na+)。(填“>”、“<”、“=”)。
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式:
。
已知1mol液态水汽化时需要吸收44 kJ热量,则1mol丁烷完全燃烧生成二氧化碳气体和气态水时,放出的热量为kJ。
(2)有同学制作一氢氧燃烧电池,通入H2的一极为极。若以稀硫酸为电解质溶液时,其正极反应式为。