下列物质在水溶液中的电离方程式不正确的是
| A.Ca(OH)2 = Ca2++ 2OH- | B.Al2(SO4)3 = 2Al3++ 3SO42- |
| C.NH4Cl = NH3 + H++Cl- | D.HNO3=H+ +NO3- |
下列关于稀有气体的说法,不正确的是
A.原子的电子排布最外层不都是以p6结束
B.化学性质非常不活泼
C.原子半径比同周期ⅦA族元素原子的大
D.其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式
第二十九届奥林匹克夏季运动会于2008年8月8日—24日在北京隆重举行并获得巨大成功。下图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃。下列说法正确的是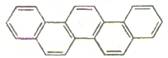
| A.该有机物的一氯代物共有四种 |
| B.该有机物是只含非极性键的非极性分子 |
| C.该有机物属于芳香族化合物,是苯的同系物 |
| D.该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量 |
在一定温度下,向a L密闭容器中加入1mol X气体和 2mol Y气体,发生如下反应:X(g)+2Y(g)  2Z(g),此反应达到平衡的标志是 ( )
2Z(g),此反应达到平衡的标志是 ( )
| A.容器内压强不随时间变化 |
| B.v正(X)=v逆(Z) |
| C.容器内X、Y、Z的浓度之比为1:2:2 |
| D.单位时间消耗0.1mol X同时生成0.2mol Z |
下列各组中两个反应所属反应类型相同的是 ( )
| A.甲烷和氯气在光照下反应;乙烯能使溴水褪色 |
| B.乙烷在氧气中燃烧;由乙烯制取聚乙烯 |
| C.乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色 |
| D.乙烯和水反应制乙醇;乙烯能使溴水褪色 |
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是()
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.Z元素的最高价氧化物的水化物的化学式为HZO4 |
| C.YX2、M2Y都是含有极性键的化合物 |
| D.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |