某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是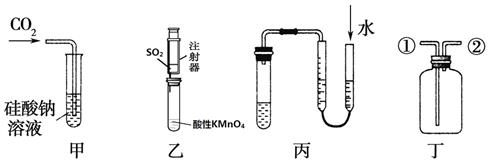
| A.甲装置:可用来证明碳的非金属性比硅强 |
| B.乙装置:可用来探究SO2的漂白性 |
| C.丙装置:用图示的方法可以检查此装置的气密性 |
| D.丁装置:从①口进气可集满二氧化碳,从②口进气,可收集氢气。 |
下列有关说法正确的是
| A.H与D互为同位素;葡萄糖和蔗糖互为同系物 |
| B.乙烷气体中混有乙烯,通入酸性高锰酸钾溶液,从而除去乙烯 |
| C.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 |
| D.证明CH3CH2CH=CHCH2CH2OH分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
以下烃中,一氯代物只有一种的是
| A.丙烷 | B.正丁烷 | C.正戊烷 | D.新戊烷 |
下列化学方程式书写错误的是
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CHO+2H2O |
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:   + H2O + H2O |
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH + CH3COOH CH3COOC2H5 + H2O CH3COOC2H5 + H2O |
| D.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+ Br2 → CH2Br-CH2Br |
下列反应属于取代反应的是
| A.乙烯 → 乙醇 | B.乙酸 →乙酸乙酯 |
| C.苯 → 环己烷 | D.乙醇 → 乙醛 |
在2L密闭容器中,发生3A+B =" 2C" (均为气体)的反应,若最初加入A和B都是4mol, A的平均反应速率是0.12mol/(L.s),则10s后容器中的B的物质的量是
| A.1.6mol | B.3.2mol | C.3.6mol | D.2.8mol |