草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2,K2=5.4×10﹣5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:
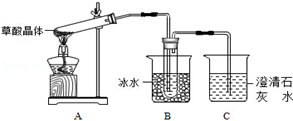
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是 ,由此可知草酸晶体分解的产物中有 .装置B的主要作用是 。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验.
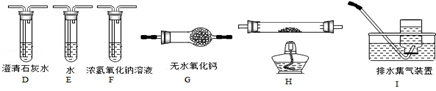
①乙组同学的实验装置中,依次连接的合理顺序为A、B、 装置H反应管中盛有的物质是 。
②能证明草酸晶体分解产物中有CO的现象是
(3)①设计实验证明:
①草酸的酸性比碳酸的强
②草酸为二元酸
某化学兴趣小组的同学,在学习了高中化学第三册中有关草酸的性质,查阅了大量资料,获得了草酸的一些信息,整理出下表:
| (1) 草酸晶体 |
分子式 |
H2C2O4·2H2O |
颜色 |
无色晶体 |
| 熔点 |
100.1℃ |
受热至100.1℃时失去结晶水,成为无水草酸。 |
||
| (2) 无水草酸 |
结构简式 |
HOOC—COOH |
溶解性 |
能溶于水或乙醇 |
| 特性 |
大约在157℃升华(175℃以上发生分解)。 |
|||
| 化学性质 |
H2C2O4 + Ba(OH)2 =BaC2O4↓+ 2H2O |
|||
| HOOC—COOH >175℃ CO2↑+CO↑+H2O↑ |
该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。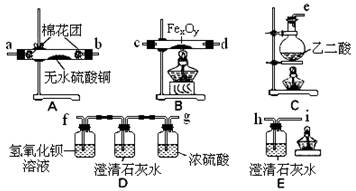
请回答下列问题:
(1)实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接、接、接、接 h 。
(2)该组同学进行了下列实验操作:
①点燃B处的酒精灯;
②检查实验装置的气密性并装入药品;
③反应结束后,先熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再熄灭c处的酒精灯;
④点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤点燃尖嘴i处的酒精灯。
正确的实验操作顺序是:。
(3)收集气体验纯的目的是。
D装置中澄清石灰水的作用是。
E装置中澄清石灰水的作用是。
(4)反应完全后,该组同学进行数据处理。反应前,称得硬质玻璃管的质量为54.00 g,样品FexOy的质量为7.84 g;反应后,称得硬质玻璃管与剩余固体的总质量为59.60g(其质量经同样操作后也不再发生变化),则样品FexOy中,x:y=。
(5)本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。
。
(18分)在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
(1) 烧瓶A中常加入碎瓷片,其作用是 ,
小试管C的作用是 。
(2) 为了安全,在E管中的反应发生前,在F出口处必须 ,
E管中的反应开始后, 在F出口处应 。
(3) 反应3Fe +4H2O(g)  Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
。
(4) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中
含有Fe3+的实验操作及现象
。
Ⅰ.拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。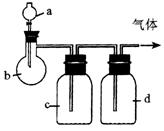
| 气体 |
a |
b |
c |
d |
| C2H4 |
乙醇 |
浓H2SO4 |
NaOH溶液 |
浓H2SO4 |
| Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
| NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
| NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
⑴上述方法中可以得到干燥、纯净的气体是 。
⑵指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体_____________,理由是_________________________________________ 。
②气体_____________,理由是_________________________________________ 。
③气体_____________,理由是_________________________________________ 。
④气体_____________,理由是_________________________________________ 。
Ⅱ.用下图装置进行实验,将A逐滴加入B 中。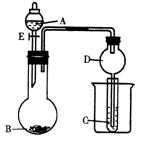
⑴若A为醋酸,B为石灰石,C为C6H5ONa溶液,则在小试管中发生的现象是
________________________________________________________________________,
其中发生反应的化学方程式为__________________________________________。
⑵若B为生石灰,实验中观察到C溶液中先产生沉淀,而后沉淀逐渐溶解。当沉淀恰好溶解时,关闭E,然后向烧杯中加入热水,静置片刻,观察到试管壁上出现银镜。则A是_________,C是__________和乙醛的混合液,发生银镜反应的化学方程式为________________________________________________仪器D在实验中的作用是__________________________________________________。
某校化学课外活动小组利用下面所提供的仪器装置和药品制取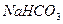 溶液,设计如下实验。实验室提供的药品、仪器装置如下:
溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2%NaOH溶液 ②稀HCl ③稀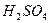 ④饱和
④饱和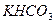 溶液 ⑤浓
溶液 ⑤浓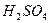 ⑥
⑥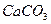 固体 ⑦
固体 ⑦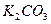 粉末仪器装置(如下图所示):
粉末仪器装置(如下图所示):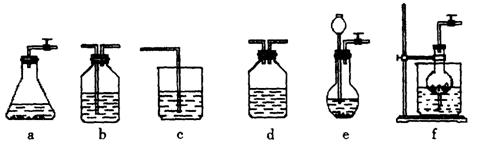
请根据题目要求回答下列问题:
(1)请按下表要求,填写选择的装置和药品。
(2)如何检验所选择的 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程:
______________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量 后,Z装置内的溶液中离子浓度大小顺序为_______________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。
后,Z装置内的溶液中离子浓度大小顺序为_______________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。
附:有关物质在常温(20℃)时的溶解度
| 化学式 |
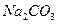 |
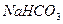 |
NaOH |
NaCl |
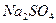 |
溶解度(g/100g ) ) |
21.3 |
9.60 |
107 |
35.8 |
19.4 |
下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置: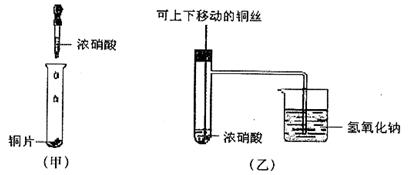

(1)写出铜和浓硝酸反应的化学方程式______________________________________。
(2)和甲装置相比,乙装置的优点__________________________________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹_______,再打开弹簧夹______________,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作____________________________________________________。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是_________________________(气体按标准状况计算)。